Galcanezumab
- Autor(en): Etzel Gysling
- pharma-kritik-Jahrgang 41
, Nummer 2, PK1069
Redaktionsschluss: 28. Juni 2019
DOI: https://doi.org/10.37667/pk.2019.1069 - PDF-Download der Printversion dieser pharma-kritik Nummer
Galcanezumab (Emgality®, LY2951742, Galcanezumab-gnlm) ist ein weiterer Hemmer des «Calcitonin Gene-Related Peptide» (CGRP), der zur Prävention von Migräneanfällen dienen kann.
Chemie/Pharmakologie
Galcanezumab, ein spezifischer humaner monoklonaler Antikörper, bindet sich mit hoher Affinität an das «Calcitonin Gene-Related Peptide» (CGRP) und verhindert so, dass sich CGRP an den Rezeptor binden kann. Der andere bisher erhältliche CGRP-Hemmer, Eremumab (Aimovig®), bindet sich direkt an die CGRP-Rezeptoren. CGRP ist ein Neuropeptid, das sich an verschiedensten Stellen des Nervensystems findet, stark vasodilatierend wirkt und Schmerzsignale vermittelt.(1)
Pharmakokinetik
Das Medikament wird subkutan injiziert. Etwa 5 Tage nach der Injektion werden maximale Plasmaspiegel erreicht. Die biologische Verfügbarkeit ist nicht genau bekannt. Die Plasma-Halbwertszeit von Galcanezumab beträgt durchschnittlich 27 Tage. Ein Fliessgleichgewicht wird erst erreicht, wenn vier Injektionen zu 300 mg monatlich verabreicht worden sind. Man nimmt an, dass Galcanezumab wie endogene Immunglobuline in kleinere Peptide und Aminosäuren abgebaut wird.
Klinische Studien
Galcanezumab ist bei episodischer Migräne (d.h. bei maximal 14 «Migränetagen» pro Monat) und bei chronischer Migräne (mehr als 15 «Migränetage» pro Monat) untersucht worden. Zudem liegen Resultate einer Doppelblindstudie bei Cluster-Kopfschmerzen vor.
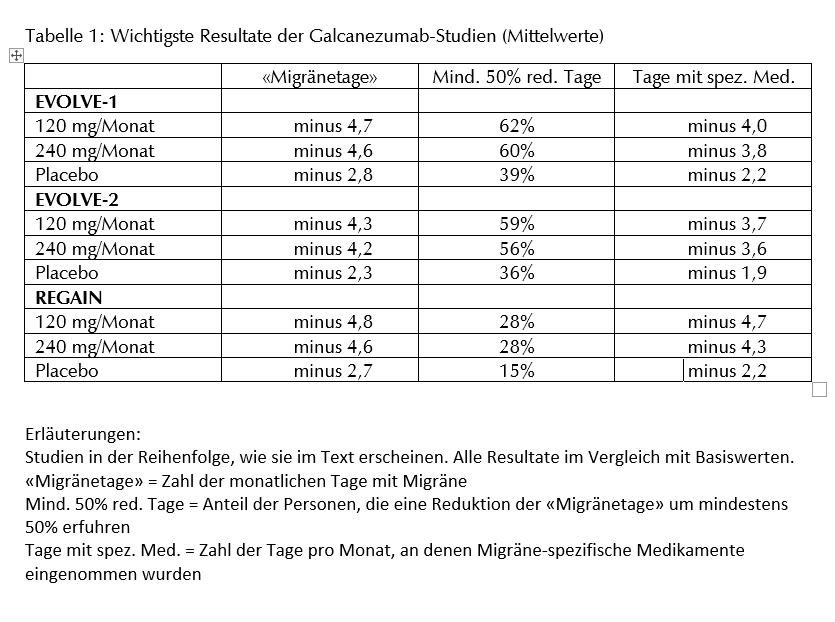
Die Studien bei episodischer Migräne können folgendermassen zusammengefasst werden (siehe auch Tabelle 1):
In einer doppelblinden Dosisfindungsstudie erhielten 410 Erwachsene mit episodischer Migräne für drei Monate monatlich eine Galcanezumab-Dosis (5, 50, 120 oder 300 mg) oder Placebo. Der primäre Endpunkt – eine gegenüber Placebo signifikant reduzierte Zahl von «Migränetagen» während des letzten Studienmonats – wurde unter den beiden höheren Galcanezumab-Dosen erreicht.(2)
Die beiden Studien EVOLVE-1 und EVOLVE-2 wurden nach einem identischen Protokoll durchgeführt, die eine in Nordamerika, die andere multinational. Bei Personen mit episodischer Migräne wurden zwei verschiedene Galcanezumab-Dosen (120 mg bzw. 240 mg monatlich, während 6 Monaten) im Doppelblindverfahren mit Placebo verglichen. Bei der 120-mg-Gruppe wurde die erste Dosis auf 240 mg verdoppelt. In beiden Studien wurden die Teilnehmenden im Verhältnis 1:1:2 auf die Gruppen mit 120 mg oder 240 mg Galcanezumab bzw. Placebo randomisiert. Der primäre Endpunkt entsprach der Veränderung der durchschnittlichen Zahl monatlicher «Migränetage» während der sechsmonatigen Doppelblindphase gegenüber dem Basiswert (vor der Studie). Sekundäre Endpunkte siehe Tabelle 1.
An der EVOLVE-1-Studie nahmen 858 Personen (wovon über 80% Frauen) teil. Diese hatten vor der Studie an durchschnittlich 9,1 Tagen monatlich Migräne-Kopfschmerzen. Hinsichtlich des primären Endpunkts waren beide Galcanezumab-Dosen signifikant wirksamer als Placebo: im Vergleich mit Placebo fand sich die Zahl der «Migränetage» mit Galcanezumab um knapp 2 Tage reduziert. Auch die Zahl der Personen, bei denen die Zahl der monatlichen «Migränetage» um mindestens 50% abnahm, war unter Galcanezumab signifikant grösser. Das anhand von verschiedenen Skalen erfasste körperliche Wohlbefinden fand sich unter dem aktiven Medikament ebenfalls stärker verbessert.(3)
An der EVOLVE-2-Studie nahmen 915 Personen (85% Frauen) teil. Auch in dieser Population hatten die Teilnehmenden vor der Studie an durchschnittlich 9,1 Tagen monatlich Migräne-Kopfschmerzen. Das Resultat war praktisch mit demjenigen der EVOLVE-1-Studie identisch. Unter Galcanezumab hatten die Teilnehmenden durchschnittlich an rund 2 Tagen weniger Migräne als unter Placebo. Erneut fand sich kein nennenswerter Unterschied zwischen der 120-mg- und der 240-mg-Dosis. Sekundäre Endpunkte: siehe Tabelle 1.(4)
Zur Wirksamkeit von Galcanezumab bei chronischer Migräne wurde bisher eine grosse Studie publiziert: An der REGAIN-Studie nahmen 1113 Personen teil, die jeden Monat mindestens 15 Tage mit Kopfschmerzen (mindestens 8 davon mit Migräne) hatten. In drei Gruppen erhielten sie monatlich Galcanezumab 120 mg (n=278) oder 240 mg (n=277) oder Placebo (n=558). Vor der Studie hatten die Teilnehmenden durchschnittlich 19 Tage mit Kopfschmerzen monatlich gemäss der erwähnten Definition (in der Publikation summarisch als «Migränetage» bezeichnet). Während der dreimonatigen Doppelblindphase fand sich die Zahl der monatlichen «Migränetage» in den Galcanezumab-Gruppen gegenüber der Placebogruppe signifikant reduziert: unter 120 mg nahm die Zahl um 4,8 Tage, unter 240 mg um 4,6 Tage, unter Placebo aber nur um 2,7 Tage ab.(5)
In einer offenen Studie erhielten 270 Erwachsene (vorwiegend Frauen) während 12 Monaten Galcanezumab (120 oder 240 mg monatlich). Die Resultate lassen vermuten, dass sich die in den ersten drei Behandlungsmonaten erreichte Abnahme der «Migränetage» im Laufe eines Jahres wenig ändert oder noch etwas verbessert.(6)
Bisher liegen keine Studien vor, in denen Galcanezumab direkt mit anderen Medikamenten zur Migräneprävention verglichen worden wäre.
Gemäss Angaben der Herstellerfirma und einem Abstract hat sich Galcanezumab auch bei Cluster-Kopfschmerzen wirksam gezeigt: In einer achtwöchigen Doppelblindstudie erhielten 106 Personen (84% Männer) monatlich 300 mg Galcanezumab (n=49) oder Placebo (n=57). Gegenüber den Basiswerten (durchschnittlich etwa 17 Cluster-Attacken wöchentlich) nahm die Häufigkeit der Cluster-Kopfschmerzen unter Galcanezumab um 8,7 Attacken/Woche, unter Placebo aber nur um 5,2 Attacken/Woche ab.(7)
Unerwünschte Wirkungen
Schmerzhafte oder entzündliche Reaktionen an der Injektionsstelle sowie Virusinfekte der oberen Luftwege sind häufig (und häufiger als mit Placebo). Bei einzelnen Personen können gegen das Medikament gerichtete Antikörper nachgewiesen werden; die therapeutische Wirkung wird aber offenbar dadurch nicht beeinträchtigt.
Wie andere CGRP-Hemmer kann Galcanezumab allergische Reaktionen verursachen. Diese treten eventuell noch Tage nach der Verabreichung auf und können relativ harmlos (Urtikaria, Exantheme) sein. Es sind auch bedrohliche Reaktionen mit Anaphylaxie, Angioödem, Dyspnoe möglich.
Theoretisch besteht das Risiko, dass die CGRP-Hemmung das Risiko kardiovaskulärer Ereignisse erhöhen könnte; bis anhin liegen jedoch keine entsprechenden Hinweise vor.
Interaktionen
Es sind bisher keine Interaktionen von klinischer Bedeutung bekannt.
Dosierung, Verabreichung, Kosten
Galcanezumab (Emgality®) ist aktuell in Form eines Fertigpens mit 120 mg erhältlich. Das Medikament ist zur präventiven Behandlung der Migräne – «sofern diese indiziert ist» – zugelassen. Sollen die Kosten von der Krankenkasse übernommen werden, ist eine Einwilligung des Vertrauensarztes der Kasse notwendig. Empfohlen wird die subkutane Injektion von 120 mg jeden Monat; bei der Erstverabreichung soll die Dosis (wie in den Studien) verdoppelt werden. (In den USA ist eine 300-mg-Dosis zur Behandlung von Cluster-Kopfschmerzen zugelassen.) Die Injektion kann durch die betroffene Person selbst oder eine Hilfsperson erfolgen, wobei darauf geachtet werden muss, nur im Bereich gesunder Haut zu injizieren. Eine Dosisanpassung bei Leber- oder Niereninsuffizienz ist nicht notwendig.
Da unerwünschte Auswirkungen nicht ausgeschlossen werden können, soll Galcanezumab in der Schwangerschaft und Stillzeit nicht verabreicht werden. Mangels entsprechender Daten wird auch von der Anwendung bei Kindern und Jugendlichen unter 18 abgeraten. Das Medikament ist zur Anwendung bei älteren Leuten (über 65) zugelassen, obwohl es in dieser Altersgruppe nicht dokumentiert wurde.
Die Behandlungskosten mit Galcanezumab (Emgality®) sind dieselben wie mit Eremumab (Aimovig®), nämlich CHF 616.20 pro Dosis. Die jährlichen Kosten einer solchen Behandlung (im ersten Jahr rund 8010 Franken) sind somit wesentlich höher als diejenigen einer präventiven Verabreichung eines Metoprolol-Generikums (etwa 160 Franken pro Jahr).
Kommentar
Wenn eine neue Behandlung schon rund fünfzigmal teurer ist als bisher verfügbare Optionen, so müsste doch nachgewiesen sein, dass sie wirklich besser ist als die «billigeren» Therapien. Weder für Galcanezumab noch für andere CGRP-Hemmer (Eremumab und weitere, die wohl bald kommen werden) ist dies aber der Fall. Dass exorbitant teure Medikamente nach wie vor allein aufgrund des Vergleichs mit Placebo zugelassen werden, ist schockierend.
Tatsächlich ist ja auch gegenüber Placebo die Überlegenheit von Galcanezumab verhältnismässig bescheiden und es besteht durchaus die Möglichkeit, dass sich gar kein Vorteil gegenüber «traditionellen» Therapien nachweisen lässt. Zu beachten ist auch, dass die Langzeitverträglichkeit der neuen Migräne-Prophylaktika noch keineswegs überzeugend dokumentiert ist.
Literatur
- 1) Lamb YN. Drugs 2018; 78: 1769-75
- 2) Skljarevski V et al. JAMA Neurol 2018; 75: 187-93
- 3) Stauffer VL et al. JAMA Neurol 2018; 75: 1080-8
- 4) Skljarevski V et al. Cephalagia 2018; 38: 1442-54
- 5) Detke HC et al. Neurology 2018; 91: e2211-21
- 6) Camporeale A et al. BMC Neurology 2018; 18: 188
- 7) Bardos JN et al. Am Acad Neurol Annual Meeting 2019; May 4-10
Standpunkte und Meinungen
- Es gibt zu diesem Artikel keine Leserkommentare.
Copyright © 2024 Infomed-Verlags-AG
PK1069
Verwandte Artikel
Gratisbuch bei einem Neuabo!
pharma-kritik abonnieren
-
Jahrgang 45 / 2023
Jahrgang 44 / 2022
Jahrgang 43 / 2021
Jahrgang 42 / 2020
Jahrgang 41 / 2019
Jahrgang 40 / 2018
Jahrgang 39 / 2017
Jahrgang 38 / 2016
Jahrgang 37 / 2015
Jahrgang 36 / 2014
Jahrgang 35 / 2013
Jahrgang 34 / 2012
Jahrgang 33 / 2011
Jahrgang 32 / 2010
Jahrgang 31 / 2009
Jahrgang 30 / 2008
Jahrgang 29 / 2007
Jahrgang 28 / 2006
Jahrgang 27 / 2005
Jahrgang 26 / 2004
Jahrgang 25 / 2003
Jahrgang 24 / 2002
Jahrgang 23 / 2001
Jahrgang 22 / 2000
Jahrgang 21 / 1999
Jahrgang 20 / 1998
Jahrgang 19 / 1997
Jahrgang 18 / 1996
Jahrgang 17 / 1995
Jahrgang 16 / 1994
Jahrgang 15 / 1993
Jahrgang 14 / 1992
Jahrgang 13 / 1991
Jahrgang 12 / 1990
Jahrgang 11 / 1989
Jahrgang 10 / 1988
Kennen Sie "100 wichtige Medikamente" schon?
Die Liste der 100 Medikamente sehen Sie auf der Startseite von 100 Medikamente.