Biologika bei Psoriasis vulgaris
- Autor(en): Andreas W. Arnold, Peter Itin
- Reviewer: Jérôme Biollaz, Peter Villiger, Nikhil Yawalkar, Kaspar Zürcher
- pharma-kritik-Jahrgang 28
, Nummer 15, PK39
Redaktionsschluss: 12. April 2007
DOI: https://doi.org/10.37667/pk.2006.39 - PDF-Download der Printversion dieser pharma-kritik Nummer
Übersicht
Mit einer Prävalenz von 2 bis 3% in Europa ist die Psoriasis eine der häufigsten Hautkrankheiten. Genetische Faktoren spielen bei der Entwicklung eine wichtige Rolle. Mehrere Psoriasis-Suszeptibilitätsgene sind heute auf verschiedenen Chromosomen lokalisiert worden. Etwa 5 bis 10% der Personen mit einer Psoriasis leiden auch unter einer Psoriasis-Arthritis, die in der Regel erst nach Beginn der Hautveränderungen manifest wird.Die Symptome der Psoriasis können mit einer erheblichen psychosozialen Beeinträchtigung einhergehen. Viele Betroffene werden auch durch die herkömmliche Therapie in ihrer Lebensqualität beeinträchtigt. Besonders die schweren Formen einer Psoriasis scheinen zudem mit einer erhöhten kardiovaskulären Morbidität verbunden zu sein,(1) was die veränderte Wahrnehmung der Psoriasis als bedeutsame Erkrankung unterstützt.
Die Erkenntnis, dass es sich bei der Psoriasis um eine T-Zell-vermittelte Autoimmunerkrankung handelt, hat die Entwicklung spezifischer Strategien zur Therapie vorangetrieben.
Grundlagen
Ein zunehmendes Verständnis der Pathogenese und das technische Vermögen, gegen definierte Moleküle im Entzündungsprozess Medikamente herzustellen, hat in den letzten Jahren zu einer Erweiterung der therapeutischen Möglichkeiten geführt. Es kam zu der Entwicklung von selektiven Immunmodulatoren, sogen. Biologika («Biologics»). Dabei handelt es sich um gentechnisch hergestellte Substanzen, die spezifisch gegen einzelne Zytokine gerichtet sind.
Etwas schematisch lassen sich die bei Psoriasis wirksamen Biologika in zwei Gruppen unterteilen, einerseits die Antagonisten des Tumornekrosefaktors alpha (TNF-alpha-Blocker), anderseits Medikamente, die in erster Linie die Aktivierung und Proliferation der T-Lymphozyten hemmen (T-Zell-Modulatoren). Der TNF alpha regt wahrscheinlich als entzündungsförderndes Zytokin die übermässige Proliferation der Hautzellen an. Aktivierte T-Lymphozyten spielen offensichtlich eine wichtige, wenn auch nicht restlos geklärte Rolle in der Pathogenese der Psoriasis. Adalimumab (Humira®), Etanercept (Enbrel®) und Infliximab (Remicade®) sind TNF-alpha-Blocker; Alefacept (Amevive®) und Efalizumab (Raptiva®) sind T-Zell-Modulatoren.
In den bisher durchgeführten klinischen Studien wurden die Biologika bei einer mittelschweren bis schweren Plaque-Psoriasis ausschliesslich im Vergleich mit Placebo geprüft. Das Ausmass der Hauterkrankung wurde anhand der betroffenen Hautoberfläche und mittels des «Psoriasis Area-and-Severity Index» (PASI) bestimmt. Der PASI-Wert ergibt sich auf Grund einer relativ komplizierten Berechnung von verschiedenen Messwerten, wobei neben der Hautoberfläche auch Juckreiz, Rötung, Schuppung und Hautverdickung berücksichtigt werden. Die PASI-Skala erstreckt sich von 0 (keine psoriatische Hautveränderung) bis 72 (maximale Ausdehnung und Intensität der Krankheit). In die Studien wurden in der Regel Personen mit einem PASI-Wert von mindestens 10 aufgenommen. In einzelnen Studien wurde auch der «Dermatology Life Quality Index» berücksichtigt. Der primäre Studienendpunkt war üblicherweise definiert als eine 75%ige Reduktion des PASI-Wertes gegenüber dem initialen Wert (sogen. PASI 75).
Einschränkungen
In der folgenden Übersicht werden diejenigen Medikamente am ausführlichsten besprochen, die bereits für die Behandlung der Plaque-Psoriasis zugelassen sind. Zu den anderen Biologika werden Kurzinformationen vermittelt. Die Indikation «Psoriasis-Arthritis» wird lediglich erwähnt, jedoch nicht dokumentiert. Wie im Folgenden gezeigt wird, ist der therapeutische Stellenwert der Biologika bisher nicht gesichert, besonders, weil kontrollierte Vergleiche mit anderen Therapien vollständig fehlen. Die noch beschränkten Erfahrungen mit diesen Medikamenten lassen auch noch keine verlässlichen Schlüsse auf die langfristigen Risiken zu. Zudem sind alle Biologika sehr teuer.
Daraus ergibt sich die Einschränkung der Indikation auf eine mittelschwere oder schwere Psoriasis, bei der die herkömmlichen Antipsoriatika (Lichttherapie, Ciclosporin, Methotrexat, Retinoide) nicht genügend wirken oder wegen Nebenwirkungen nicht eingesetzt werden können. Bei einer mittelschweren oder schweren Psoriasis sind mehr als 10% der Körperoberfläche betroffen, es besteht eine körperliche Beeinträchtigung im Alltag (z.B. Befall der Plantae und Palmae) oder eine starke Beeinträchtigung der Lebensqualität (z.B. beim Befall der Genitalregion). In allen Fällen sind jedoch auch die Kontraindikationen der Biologika zu berücksichtigen (siehe Tabelle 1). Biologika können bei der Psoriasis nur von Fachärztinnen und Fachärzten der Dermatologie verschrieben werden. Für die Kostengutsprache ist ein Gesuch an den Schweizerischen Verband für Gemeinschaftsaufgaben der Krankenversicherer (SVK) notwendig.
TNF-alpha-Hemmer
Adalimumab
Adalimumab (Humira®), ein humaner monoklonaler Antikörper, ist ein TNF-alpha-Blocker, der bisher noch nicht zur Behandlung der Plaque-Psoriasis zugelassen ist. Zugelassen ist das Medikament bei Psoriasis-Arthritis, wenn diese ungenügend auf die herkömmlichen Basistherapeutika (wie z.B. Methotrexat) reagiert.
In einer relativ kleinen Doppelblindstudie erhielten 147 Personen mit einer Plaque-Psoriasis wöchentlich oder jede zweite Woche Adalimumab (40 mg subkutan) oder Placebo. Nach 12 Wochen erreichten 80% der Personen, die jede Woche behandelt wurden, einen PASI 75; unter der niedrigeren Dosis waren es 53% und unter Placebo nur 4%. (2) Die unerwünschten Wirkungen von Adalimumab entsprechen weitgehend denjenigen von Etanercept (siehe unten).
Etanercept
Etanercept (Enbrel®) ist ein humanes Fusionsprotein, das sich aus zwei natürlich vorkommenden TNF-alpha-Rezeptorstrukturen zusammensetzt. Es bindet sich kompetitiv an lösliche TNF-a-Trimere und verhindert so, dass sich diese an Rezeptoren der Zelloberfläche binden können. Zusätzlich bindet sich das Medikament auch an Lymphotoxin alpha(TNF alpha). Etanercept ist sowohl bei schwerer Plaque-Psoriasis als auch bei Psoriasis-Arthritis zugelassen, sofern diese Erkrankungen nicht genügend auf die übliche Basistherapie ansprechen.
Klinische Studien
Die Resultate von drei Doppelblindstudien mit Etanercept lassen schliessen, dass sich bei der Plaque-Psoriasis mit einer Dosis von 25 mg zweimal wöchentlich nach 12 Wochen bei 34% und nach 24 Wochen bei 45% der Behandelten ein PASI 75 erreichen lässt. Der gleiche Endpunkt wird unter der doppelten Dosis (2-mal 50 mg/Woche) nach 12 Wochen von etwa 48%, nach 24 Wochen von 59% der Behandelten erreicht. Unter Placebo wird nach 12 Wochen lediglich bei rund 4% ein PASI 75 beobachtet. Unter Etanercept beginnen die PASI-Werte nach der zweiten Behandlungswoche zu sinken und bessern sich kontinuierlich bis zur 12. Woche; anschliessend flacht sich die Kurve ab.(3-5)
Unerwünschte Wirkungen
Infekte sind eine sehr häufige Begleiterscheinung einer Behandlung mit Etanercept. Insgesamt treten Infektionen bei etwa 30% der Behandelten auf; allerdings handelt es sich meistens um leichte Infektionen wie Pharyngitis, Bronchitis, Zystitis u.ä. Gefährliche Infektionen und eine Sepsis sind jedoch möglich. Gefürchtet ist auch die Reaktivierung einer Tuberkulose. Wichtig ist zu bemerken, dass die Symptome einer Infektion – Fieber, Krankheitsgefühl - durch die Blockade des TNF-a vermindert sind und deshalb häufig erst spät, wenn überhaupt, bemerkt werden.
Ebenfalls sehr häufig kommt es an der Injektionsstelle zu einer lokalen Reizung (Rötung, Schwellung, Juckreiz, Blutung, Schwellung) und häufig auch zu Kopfschmerzen. Die Lokalreaktion klingt in der Regel nach 3-5 Tagen spontan wieder ab.
Häufig – bei 11% mehr als unter Placebo – werden Autoantikörper festgestellt, gelegentlich kommt es auch zu einem (nach dem Absetzen von Etanercept reversiblen) Lupus-ähnlichen Syndrom.(6) Ob und in welchem Ausmass eine längerfristige Etanercept-Behandlung zu Autoimmunerkrankungen (z.B. einem Lupus erythematodes) oder zu Malignomen führt, ist nicht genau bekannt. Bei Personen unter einer Langzeittherapie werden Lymphome dreimal häufiger beobachtet als allgemein in der Bevölkerung.
Antikörper gegen Etanercept werden initial selten, langfristig jedoch relativ häufig beobachtet. Bisher konnten jedoch keine (die Wirkung beeinträchtigenden) neutralisierenden Antikörper nachgewiesen werden.
Eine vorbestehende Herzinsuffizienz kann sich unter Etanercept verschlechtern. Selten kommen Blutbildungsstörungen vor; eine aplastische Anämie ist sehr selten. Es ist nicht ausgeschlossen, dass Etanercept zu demyelinisierenden Erkrankungen (d.h. zu multipler Sklerose) führen kann.
Dosierung und Verabreichung
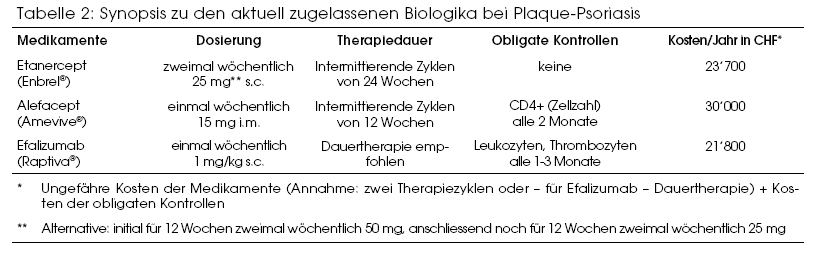
Die Plaque-Psoriasis wird üblicherweise für 12 bis 24 Wochen mit zweimal wöchentlich 25 mg (subkutan) behandelt. In schweren Fällen kann in den ersten 12 Wochen zweimal wöchentlich 50 mg gegeben werden, gefolgt von zweimal wöchentlich 25 mg für weitere 12 Wochen. So kommt es zu einer schnelleren Besserung der Symptomatik. Eine Hochdosistherapie (mit zweimal wöchentlich 50 mg während 24 Wochen) wird nicht empfohlen, da noch nicht genügend erwiesen ist, dass diese einen relevanten Zusatznutzen erbringt und verträglich ist. Nach 24 Wochen wird die Therapie abgebrochen und erst bei erneuter Verschlechterung wieder begonnen. Siehe auch Tabelle 2.
Bei Psoriasis-Arthritis wird eine kontinuierliche Therapie durchgeführt. Dokumentiert ist die Verabreichung von zweimal wöchentlich 25 mg s.c. Etanercept kann dabei gemeinsam mit Methotrexat oder Steroiden eingesetzt werden.
Vor der Verabreichung von Etanercept ist sicherzustellen, dass keine Kontraindikation (vgl. Tabelle 1) vorliegt. Bei Verdacht auf eine latente Tuberkulose sollen ein Thorax-Röntgenbild und ein Tuberkulosetest (am besten ein sogen. Interferon-alpha-Test) durchgeführt werden.
Infliximab
Infliximab (Remicade®), ein monoklonaler chimärer Antikörper, ist ein hoch spezifischer TNF-alpha-Blocker, der sich an löslichen TNF alpha bindet und zudem auch TNF-alpha-Moleküle neutralisieren kann, die bereits an Membranrezeptoren gebunden sind. Dieses Medikament ist bisher in der Schweiz für die Behandlung der Plaque-Psoriasis noch nicht zugelassen, wohl aber für die Psoriasis-Arthritis (bisher aber nicht kassenzulässig). Eine Zulassung für Plaque-Psoriasis existiert bisher in Grossbritannien und in den USA.
Zur Wirksamkeit von Infliximab bei einer Plaque-Psoriasis gibt es – neben kleineren Untersuchungen – eine grosse, 46 Wochen dauernde Doppelblindstudie. In dieser wurden Infliximab-Infusionen (5 mg/kg) mit Placebo verglichen, wobei die Infusionen in den Wochen 0, 2, 6 und anschliessend alle 8 Wochen erfolgten. Von der 24. Woche an erhielten auch diejenigen, die bis dahin zur Placebogruppe gehörten, Infliximab. In der Woche 10 war unter Infliximab bei 80% ein PASI 75 erreicht, dieser Wert nahm bis zur Woche 24 noch zu (82%), reduzierte sich jedoch anschliessend auf 61% am Ende der Studie.(7) Eine abnehmende Wirkung wurde bei Personen gefunden, bei denen sich keine stabilen Plasmaspiegel nachweisen liessen; dies waren in der Regel solche, die Antikörper gegen Infliximab bildeten.
Die unerwünschten Wirkungen von Infliximab entsprechen grundsätzlich denjenigen anderer TNF-alpha§-Hemmer (siehe: Etanercept). Zusätzlich sind die Infusionsreaktionen zu erwähnen: vorwiegend nach den ersten zwei Infusionen treten sehr häufig Fieber, Schüttelfrost, Pruritus, Urtikaria, Bronchospasmus, Hypotonie und Larynx-/Pharynxödeme auf.
T-Zell-Modulatoren
Alefacept
Alefacept (Amevive®) ist ein vollständig humanes Fusionsprotein, das sich aus dem Typ 3 des Leukozytenfunktions-Antigens («leukocyte function-associated antigen-3, LFA-3) und dem Fc-Anteil des humanen IgG1 zusammensetzt. Das Medikament bindet sich an den Oberflächenrezeptor CD2 der Gedächtnis-T-Lymphozyten, was die Aktivierung und Proliferation dieser T-Zellen hemmt. Alefacept reduziert so dosisabhängig und reversibel die Zahl zirkulierender T-Zellen vom Typ CD4+, die in der Haut von Personen mit Psoriasis gehäuft vorkommen. Das Medikament ist in der Schweiz und in den USA zur Behandlung der Plaque-Psoriasis zugelassen.
Klinische Studien
Die intramuskuläre Anwendung von Alefacept wurde in einer Doppelblindstudie mit Placebo verglichen. Das Präparat wurde während 12 Wochen einmal wöchentlich in einer Dosis von 10 oder 15 mg injiziert; anschliessend folgten weitere 12 Wochen Beobachtung.
Maximal 33% der mit 15 mg wöchentlich Behandelten erreichten während oder nach der Studie einen PASI 75; 2 Wochen nach Ende der Behandlung waren es 21%. Für die kleinere Dosis fand sich zum letzteren Zeitpunkt kein signifikanter Unterschied zur Placebogruppe.(8,9) Die Wirkung von Alefacept setzt erst etwa 6 bis 8 Wochen nach Therapiebeginn ein. Sie hält dafür im Vergleich zu den anderen Biologika länger an und kann sich noch während einigen Wochen nach dem Abschluss der Therapie verbessern.(9) Ein «Rebound» nach Therapieende wird nicht beobachtet.
Es gibt auch eine Studie, in der Alefacept intravenös gegeben wurde. In den USA ist deshalb das Medikament auch in dieser Form zugelassen.
Das Medikament ist wahrscheinlich auch bei Psoriasis-Arthritis wirksam, aber bisher für diese Indikation nicht zugelassen.
Unerwünschte Wirkungen
Entsprechend dem Wirkungsmechanismus steht eine Lymphopenie als Nebenwirkung im Vordergrund. Die Gesamtzahl und besonders die Zahl der Lymphozyten der Typen CD4+ und CD8+ sinkt mehr oder weniger häufig ab. Nach der Beendigung der Therapie steigen die Werte wieder an, normalisieren sich jedoch innerhalb von 3 Monaten nicht ganz.
Häufig sind leichte Infektionen wie z.B. Pharyngitis; schwerwiegende Infektionen (z.B. Abszesse, Cholezystitis, Pneumonie) waren in den Studien unter Alefacept zwar selten, aber doch etwa dreimal häufiger als unter Placebo. Unter Alefacept wurden auch maligne Tumoren (vorwiegend Hautkarzinome, aber auch Lymphome) häufiger als unter Placebo beobachtet. Dies trifft auch zu auf Kopfschmerzen, Pruritus, Nausea, Myalgie, Schüttelfrost, Fieber und Schwindel. Lokale Reaktionen an der Injektionsstelle sind häufig. Es gibt Berichte über Einzelfälle von Angioödem, Urtikaria und Transaminasen-Anstieg. In den Studien haben rund 3% der Behandelten Antikörper gegen Alefacept entwickelt.
Dosierung und Verabreichung
Alefacept wird einmal wöchentlich in einer Dosis von 15 mg intramuskulär injiziert. Die Dauer eines Behandlungszyklus soll 12 Wochen nicht überschreiten, dieser darf jedoch nach einer mindestens 12-wöchigen Pause wiederholt werden. Eine längere Anwendung ist noch nicht genügend untersucht. Der Hersteller rät von der gleichzeitigen Verabreichung anderer Immunsuppressiva ab. Eine Kombination mit Phototherapie ist möglich. Wenn nach einer Alefacepttherapie mit einem anderen Immunsuppressivum weitergefahren werden soll, muss solange zugewartet werden, bis sich die Lymphozytenzahlen normalisiert haben.
Vor Therapiebeginn ist sicherzustellen, dass die Gesamtlymphozytenzahl und die CD4-Zellzahl normal sind. Danach muss die CD4-Zellzahl alle 2 Wochen bestimmt werden. Bei einem Absinken unter 250 Zellen/µl muss das Präparat abgesetzt oder mindestens unterbrochen werden.
Efalizumab
Efalizumab (Raptiva®) ist ein humanisierter monoklonaler Antikörper, der sich gegen CD-11a richtet. CD-11a ist eine Untereinheit des Typs 1 des Leukozytenfunktions-Antigens (LFA-1). Letzteres vermittelt Zelladhäsionen zwischen T-Lymphozyten und Antigen-präsentierenden Zellen sowie Endothelzellen. Die blockierende Wirkung von Efalizumab verhindert die Extravasation von T-Zellen in das entzündliche Gewebe, unterbindet die Aktivierung der T-Zellen durch Antigen-präsentierende Zellen und reduziert die Verbindung von T-Zellen mit den Keratinozyten. Das Präparat ist weltweit bei Plaque-Psoriasis zugelassen; es ist nicht bekannt, ob es bei Psoriasis-Arthritis wirksam ist.
Klinische Studien
In drei grossen Doppelblindstudien erreichten 22%, 27% bzw. 39% der wöchentlich subkutan mit Efalizumab (1 mg/kg) Behandelten einen PASI 75, während dieser Wert unter Placebo von weniger als 5% erreicht wurde.(10-12) Wurde anschliessend nochmals während 12 Wochen aktiv behandelt, so stieg der PASI 75 nochmals an.(13,14) Gemäss der globalen ärztlichen Beurteilung hatten nach 24 Wochen 36% keine oder nur noch geringgradige Psoriasissymptome.(13) Eine höhere Dosis (2 mg/kg/Woche) erbrachte dagegen nur ein wenig besseres oder gar ein schlechteres Resultat. Zudem ist das Risiko eines Rebounds nach Absetzen der Therapie (vgl. unten) umso grösser, je länger die Behandlung dauert.(15)
Unerwünschte Wirkungen
Das Hauptproblem von Efalizumab ist eine Verschlechterung der Psoriasis-Symptomatik, die nach Beginn der Therapie («Flare up») oder nach der Beendigung («Rebound») auftreten kann. Dabei wird bei etwa 5% der Betroffenen ein ungünstigerer Subtyp der Psoriasis (z.B. pustulöse Psoriasis, Psoriasis arthropathica) manifest. Rund 3% der Behandelten sind von einem «Flare up», rund 15% von einem «Rebound» betroffen.(16) Etwa 4 bis 8 Wochen nach Therapiebeginn kann auch eine transitorische neutrophile Dermatose («localized mild breakthrough») auftreten, die jedoch kein Sistieren des Medikamentes bedingt. Es handelt sich hierbei um eine papulöse, histologisch neutrophilenreiche Dermatose, welche unabhängig von der Wirksamkeit des Präparates an Hals, Rumpf und grossen Beugen ausserhalb der bestehenden Psoriasisläsionen auftritt. Diese Dermatose ist vorübergehend und kann mit lokalen Steroiden meist problemlos behandelt werden.(17)
Nach den ersten Injektionen tritt bei mehr als der Hälfte der Behandelten ein Grippe-ähnliches Syndrom mit Kopfschmerzen, Fieber und Schüttelfrost auf. Eine asymptomatische Lymphozytose ist sehr häufig, eine Thromozytopenie dagegen selten. Einige Fälle von hämolytischer Anämie sind beobachtet worden.
Wie andere Biologika kann Efalizumab das Risiko von Infektionen und malignen Tumoren erhöhen; Einzelfälle von Lymphomen unter Efalizumab sind bekannt. Auch ist mit der Möglichkeit der Reaktivierung einer latenten Tuberkulose zu rechnen.
Dosierung und Verabreichung
Efalizumab wird einmal wöchentlich subkutan verabreicht. Die erste Dosis soll auf 0,7 mg/kg beschränkt werden, nachher wird mit 1 mg/kg fortgefahren. Bei Personen mit Sonderformen von Psoriasis (z.B. Psoriasis guttata) ist Efalizumab nicht indiziert. Der Hersteller rät von der gleichzeitigen Verabreichung anderer Immunsuppressiva ab. Ist nach 12 Wochen kein relevanter therapeutischer Effekt erreicht, so muss Efalizumab abgesetzt werden.
Nach dem Absetzen von Efalizumab ist wegen des Rebound-Risikos eine engmaschige klinische Kontrolle notwendig.
Vor der Therapie sollten die Thrombozyten und Leukozyten bestimmt werden. Diese Untersuchung wird anschliessend während den ersten 3 Monaten monatlich, danach alle 3 Monate wiederholt.
Schlussfolgerungen
Die Perspektive, mit einigermassen einfach zu handhabenden Medikamenten die Symptome einer schweren Psoriasis unter Kontrolle zu bringen, ist für die von dieser hartnäckigen Hautkrankheit Betroffenen natürlich positiv. Der aktuelle Wissensstand ist jedoch nicht so, dass sich diese optimistische Erwartung auf verlässliche Daten stützen könnte. Biologika wurden bei Psoriasis bisher erst mit Placebo verglichen und zwar in der Regel nicht bei Personen, bei denen eine initiale systemische Therapie (z.B. Methotrexat) versagt hätte. Somit lässt sich zur Wirksamkeit lediglich aussagen, die heute verfügbaren Biologika wahrscheinlich ähnlich wirksam sind wie eine herkömmliche Therapie. Der indirekte Vergleich mit Methotrexat fällt zu Ungunsten der aktuell zugelassenen Biologika aus, da Methotrexat einen PASI 75 von etwa 60% erreicht.(18) Unbestimmt ist ferner, ob es bezüglich Wirksamkeit und Verträglichkeit relevante Unterschiede zwischen den verschiedenen Biologika gibt. Ins Gewicht fallen auch die fehlenden Langzeiterfahrungen bei Psoriasis, besonders in Anbetracht des Infektionsrisikos und der noch nicht definitiv geklärten Frage der Tumorförderung durch Biologika. Berücksichtigt man zudem die ungewöhnlich hohen Kosten dieser Medikamente, so muss man schliessen, dass Biologika nur mit grösster Zurückhaltung als Medikamente zweiter oder dritter Wahl bei Personen mit einer schweren Plaque-Psoriasis verschrieben werden sollten.
Literatur
- 1) Neimann AL et al. J Am Acad Dermatol 2006; 55: 829-35
- 2) Gordon KB et al. J Am Acad Dermatol 2006; 55: 598-606
- 3) Tyring S et al. Lancet 2006; 367: 29-35
- 4) Papp KA et al. Br J Dermatol 2005; 152: 1304-12
- 5) Leonardi CL et al. N Engl J Med 2003; 349: 2014-22
- 6) Wozel G. Hautarzt 2005; 56: 819-30
- 7) Reich K et al. Lancet 2005; 366: 1367-74
- 8) Ortonnne JP et al. J Eur Acad Dermatol Venereol 2003; 17 (Suppl 2): 12-6
- 9) Lebwohl M et al. Arch Dermatol 2003; 139: 719-27
- 10) Gordon KB et al. JAMA 2003; 290: 3073-80
- 11) Lebwohl M et al. N Engl J Med 2003; 349: 2004-13
- 12) Leonardi CL et al. J Am Acad Dermatol 2005; 52: 425-33
- 13) Menter A et al. Arch Dermatol 2005; 141: 31-8
- 14) Leonardi CL et al. Dermatol Ther 2004; 17: 393-400
- 15) Prinz JC. Hautarzt 2005; 56: 812-8
- 16) Carey W et al. J Am Acad Dermatol 2006; 54: S171-81
- 17) Thielen AM et al. Dermatology 2005; 211: 209-17
- 18) Heydendael VM et al. N Engl J Med 2003; 349: 658-65
Standpunkte und Meinungen
- Es gibt zu diesem Artikel keine Leserkommentare.
Copyright © 2024 Infomed-Verlags-AG
PK39
Gratisbuch bei einem Neuabo!
pharma-kritik abonnieren
-
Jahrgang 45 / 2023
Jahrgang 44 / 2022
Jahrgang 43 / 2021
Jahrgang 42 / 2020
Jahrgang 41 / 2019
Jahrgang 40 / 2018
Jahrgang 39 / 2017
Jahrgang 38 / 2016
Jahrgang 37 / 2015
Jahrgang 36 / 2014
Jahrgang 35 / 2013
Jahrgang 34 / 2012
Jahrgang 33 / 2011
Jahrgang 32 / 2010
Jahrgang 31 / 2009
Jahrgang 30 / 2008
Jahrgang 29 / 2007
Jahrgang 28 / 2006
Jahrgang 27 / 2005
Jahrgang 26 / 2004
Jahrgang 25 / 2003
Jahrgang 24 / 2002
Jahrgang 23 / 2001
Jahrgang 22 / 2000
Jahrgang 21 / 1999
Jahrgang 20 / 1998
Jahrgang 19 / 1997
Jahrgang 18 / 1996
Jahrgang 17 / 1995
Jahrgang 16 / 1994
Jahrgang 15 / 1993
Jahrgang 14 / 1992
Jahrgang 13 / 1991
Jahrgang 12 / 1990
Jahrgang 11 / 1989
Jahrgang 10 / 1988
Kennen Sie "100 wichtige Medikamente" schon?
Die Liste der 100 Medikamente sehen Sie auf der Startseite von 100 Medikamente.