Chronische Wunden
- Autor(en): Urspeter Masche
- Reviewer: Silvia Gretener, Christine Hoff, Christina Jeanneret, T. Karl, S. Läuchli
- pharma-kritik-Jahrgang 32
, Nummer 6/7, PK771
Redaktionsschluss: 3. Januar 2011
DOI: https://doi.org/10.37667/pk.2010.771 - PDF-Download der Printversion dieser pharma-kritik Nummer
Die meisten Wunden pflegen – unabhängig von ihrer Ätiologie – ohne Komplikationen abzuheilen. Zuweilen stehen aber Begleitumstände einer Abheilung entgegen und lassen eine chronische Wunde entstehen. Faktoren, welche die Wundheilung beeinträchtigen können, sind in Tabelle 1 aufgeführt. Eine chronische Wunde wird definiert als Wunde, die nach einer bestimmten Dauer keinen Heilungsprozess erkennen lässt, wobei die Grenze unterschiedlich gezogen wird ( zum Teil schon nach vier Wochen, zum Teil aber auch erst nach drei Monaten ) . Die meisten chronischen Wunden entwickeln sich aufgrund einer Gefässerkrankung ( chronische venöse Insuffizienz, peripher-arterielle Verschlusskrankheit ) , eines Diabetes mellitus oder einer Druckschädigung. Andere Ursachen ( Immunschwäche, Bindegewebserkrankungen u.a. ) machen nur einen kleinen Anteil von 5 bis 10% aus. Für chronische Wunden wird oft auch der Begriff des Ulkus verwendet, der im Prinzip aber nur deskriptiv ist und einen Substanzdefekt beschreibt, der mindestens bis in die Dermis reicht. Um eine chronische Wunde zu beurteilen, sollte man sowohl die Wunde selbst prüfen – in Bezug auf Lokalisation, Ausdehnung, Wundbett, Wundränder und Wundtaschen – als auch die umgebende Haut. Beim Wundbett ist auf Nekrosen, Fibrinbeläge oder Granulationsgewebe zu achten. Ferner ist die Menge und Art von Exsudat abzuschätzen und zu beurteilen, ob die Wunde auf tiefere Gewebe wie Muskulatur oder Faszien übergreift. Ist Knochen sicht- oder sondierbar ( «probe-to-bone» ) , besteht mit hoher Wahrscheinlichkeit eine chronische Osteomyelitis.
Wichtigste Arten von chronischen Wunden
Bevor eine chronische Wunde behandelt wird, muss die Ätiologie geklärt werden, damit eine kausale Therapie möglich ist.
Venöse Ulzera
Venöse Ulzera machen über zwei Drittel der chronischen Wunden an den Beinen aus. Sie entstehen als Folge einer chronischen venösen Insuffizienz, die auf einer Obstruktion der Venen oder einer Venenklappendysfunktion beruht, wie sie zum Beispiel bei Varikosis oder nach einer Thrombose entstehen kann. Leute mit chronischer venöser Insuffizienz klagen manchmal – unspezifisch – über schwere Beine, Druckgefühl oder Schmerzen in den Beinen. Typische Zeichen sind Knöchelödeme, Hyperpigmentierung infolge Hämosiderin-Ablagerungen und ekzematöse Veränderungen ( die aber auch eine Sensibilisierung gegenüber Lokalbehandlungen bedeuten können ) . Venöse Ulzera findet man meist zwischen Knöchel und Unterschenkelmitte ( sogenannte Gamaschenzone ) , am häufigsten oberhalb des Innenknöchels. Sie sind flach und nicht auf tiefere Strukturen übergreifend. Zur Abklärung des Venensystems hat sich die Duplexsonographie als Standard etabliert. Bei venösen Ulzera muss immer auch die arterielle Durchblutung überprüft werden.
Die Grundlage der Behandlung von venösen Ulzera ist die Kompression mit Hilfe von Kurzzugbinden oder Strümpfen. Gegebenenfalls ist bei einer Varikosis an eine operative Kausaltherapie zu denken. Kompressionsstrümpfe empfehlen sich auch zur Prophylaxe bei einem abgeheilten Ulkus. Ob eine Kompressionsbehandlung möglich ist, wenn gleichzeitig eine relevante peripher-arterielle Verschlusskrankheit besteht, sollte von einer angiologischen Fachperson beurteilt werden.
Arterielle Ulzera
Arterielle Ulzera entwickeln sich bei verminderter Blutzufuhr,
die zu Gewebshypoxie führt. Häufigste Ursache ist eine Arteriosklerose der grösseren Arterien ( peripher-arterielle Verschlusskrankheit = PAVK ) . Die rein arteriellen Ulzera werden besser als Nekrosen oder Gangrän bezeichnet ( Stadium IV nach Fontaine ) . Sie treten vor allem an den Zehen auf. Als erste Abklärungsschritte bei arteriellen Ulzera soll man den Pulsstatus erfassen und eine Verschlussdruckmessung durchführen, und zwar zur Bestimmung des Knöchel-Arm-Index oder der Differenz von Oberarm- minus Knöcheldruck ( die im Liegen normalerweise nicht grösser als 5 mm Hg ist ) . Als spezifische Therapie arterieller Nekrosen stehen revaskularisierende Eingriffe im Vordergrund.
Diabetische Ulzera
Ulzera gehören zu den wichtigsten und mit hohen Kosten ver-
bundenen Komplikationen beim Diabetes mellitus ( vor einigen Jahren hat sich eine ganze «pharma-kritik»-Nummer mit diesem Problem befasst ). (1)
Im Prinzip handelt es sich nicht nur um eine lokale Wunde, sondern um ein komplexes Krankheitsbild ( Syndrom des diabetischen Fusses ).
Als häufigste Ursache liegt eine distale symmetrische Polyneuropathie vor. Auch eine Makroangiopathie ( PAVK ) kann mitverantwortlich sein; sie birgt das höchste Risiko für eine Amputation im Ober- oder Unterschenkelbereich ( «major amputation» ) . Schwierig bleibt die Beurteilung, wenn Polyneuropathie und PAVK zusammentreffen und Schmerzen als wichtiges Leitsymptom fehlen.
Die motorische Komponente der Neuropathie führt über eine Schwächung der intrinsischen Fussmuskeln zum Beispiel zu Krallenzellen, woraus sich Druckstellen entwickeln, während die sensorische und die autonome Neuropathie das Risiko von Mikrotraumen und die Empfindlichkeit der Haut gegenüber solchen Schädigungen erhöhen. Die Haut selbst ist trocken und weist viele Hyperkeratosen auf.
Ein häufig nicht diagnostiziertes Krankheitsbild ist der Charcot-Fuss, eine nicht-infektiöse, schmerzlose Zerstörung des Fussskelettes, die initial nur durch eine Schwellung und Überwärmung auffällt und im weiteren Verlauf zu einer Fussdeformität und zu Ulzera führt. Bei Diabeteskranken ist deshalb die regelmässige Fussinspektion und fachgerechte Fusspflege eine wichtige Präventionsmassnahme, wobei insbesondere Schwielen als Gefahrenstellen zu identifizieren sind.
Bei den diabetischen Ulzera ist selbstredend, dass eine gute Blutzuckereinstellung angestrebt werden soll. Sofern eine relevante Durchblutungsstörung vorhanden ist, bieten sich revaskularisierende Eingriffe an. Ferner ist eine Entlastung der Druckstellen mit geeignetem Schuhwerk oder anderen Massnahmen ins Auge zu fassen.
Druck- oder Dekubitalulzera
Druck- oder Dekubitalgeschwüre bilden sich, wenn der Druck
aufs Gewebe den Kapillardruck übersteigt und zu einer Ischämie führt. Dies kommt typischerweise über Knochenvorsprüngen vor, am häufigsten im Bereich des Beckengürtels und an den Fersen. Im Frühstadium äussern sich Druckgeschwüre oft nur mit einer Hautrötung und sind deshalb schwierig zu erkennen. Ausserdem können bei Druckläsionen, ohne dass die Epidermis sichtbar geschädigt ist, Nekrosen in der Subkutis oder den Muskeln vorliegen – Gewebe, die auf Sauerstoffmangel empfindlicher reagieren als die Epidermis. Prädisponierende Faktoren für Druckulzera sind Immobilität, Lähmungen und Feuchtigkeit ( Inkontinenz ) ; das heisst, es sind vor allem ältere Leute und Rückenmarksverletzte betroffen. Mechanisch wird die Entstehung eines Ulkus nicht nur durch Druck gefördert, sondern auch durch Reibung oder Scherung, die auf die Haut einwirken; Reibung ergibt sich, wenn die Hautoberfläche relativ zu einer anderen Oberfläche bewegt wird, Scherung, wenn die Haut relativ zu Knochen oder Subkutangewebe verzogen wird ( was z.B. in einem Bett passieren kann, dessen Kopfteil höher als 30° gestellt ist ) . Druckgeschwür-Gefährdete sollen auf speziellen Matratzen ( z.B. aus Schaumstoff ) und Sitzkissen ruhen und regelmässig umgelagert werden. (2)
Auf den Wert solcher Matratzen weisen auch die Ergebnisse kontrollierter Studien hin.(3) Ferner sollte man eine Fehl- oder Mangelernährung vermeiden und auf eine gute Hautpflege achten.(4)
Bei der Behandlung von Druckgeschwüren gelten dieselben Prinzipien wie bei der Prophylaxe, das heisst, das Ulkus muss durch eine geeignete Lagerung und regelmässigen Positionswechsel konsequent entlastet werden. Bei ausgedehnten Dekubitalulzera braucht es für die definitive Heilung unter Umständen auch einen plastischen chirurgischen Eingriff.
Unspezifische Lokalbehandlung
Alle chronischen Wunden ( ausser arteriell bedingte Nekrosen )
sollten gründlich gesäubert werden. Meistens werden dafür isotonische Salzlösungen eingesetzt. Auch sanftes Abtupfen mit einer Gaze hilft bei der Reinigung. Ob andere, speziellere Methoden der Wundreinigung Vorteile bieten, lässt sich anhand der vorhandenen Daten nicht beantworten.(5)
Abzuraten ist von einer routinemässigen Anwendung von desinfizierend wirkenden Antiseptika, da dies die Wundheilung nicht beschleunigt.(6)
Chronische Wunden sollen feucht gehalten werden: wie man heute weiss, heilen Wunden – wiederum mit Ausnahme der arteriell bedingten Nekrosen – in einem feuchten Milieu besser als in einem trockenen.
Débridement
Das Débridement, das Entfernen von nicht-vitalem Gewebe
( Nekrosen, Fibrinbelägen ) , lässt sich als Teil der Reinigung auffassen. Es hilft zur Beurteilung der Wunde, und mit der Beseitigung von Nekrosen werden mögliche Infektherde eliminiert. Nach dem Débridement sollte sauberes, vitales Gewebe zurückbleiben, mit Wundrändern aus gesunder, blutender und weicher ( nicht-hyperkeratotischer ) Haut. Obschon der Nutzen des Débridements nach Evidenz-basierten Kriterien ungenügend untersucht ist, (7) wird nicht ernsthaft an dessen Wirksamkeit gezweifelt.
Am häufigsten führt man das Débridement chirurgisch mit scharfen Instrumenten durch – die Methode, die am schnellsten zum Erfolg führt, jedoch eine gewisse Übung erfordert, damit die Wunde nicht verschlimmert wird. Das chirurgische Débridement eignet sich besonders, wenn sich nicht-vitales Gewebe gut von gesundem abgrenzen lässt.
Andere Arten des Débridements kommen als Alternative oder Ergänzung in Frage. Mit den steril gezüchteten Larven der Goldfliege ( Lucilia sericata ) kann man ein «biochirurgisches» Débridement durchführen. Das Verdauungssekret der Fliegenlarven enthält proteolytische Enzyme, die ihnen helfen, sich von nekrotischem Gewebe zu ernähren ( das gesunde Gewebe bleibt unangetastet ) . Dem Verdauungssekret werden auch antibakterielle Eigenschaften zugeschrieben. Das Débridement mit Fliegenlarven kommt vor allem bei nekrotischen, infizierten Wunden in Frage.(8) Da atraumatisch, wird sie als vorteilhafte Methode bezeichnet, wenn die Gefässversorgung schlecht ist. Auch andere proteolytische Enzyme – aus Bakterienprodukten, Pflanzen oder tierischen Geweben gewonnen – können fürs Débridement verwendet werden; Beispiele sind Kollagenasen, Streptokinase, Papain oder Bromelain. Es gibt in der Schweiz zwei solche Enzymprodukte: Fibrolan®, das Fibrinolysin und Desoxyribonuklease, sowie Iruxol®, das Clostridiopeptidase A ( eine bakterielle Kollagenase ) enthält. Wegen unberechenbarer Wirkung gelten proteolytische Enzyme aber als umstritten.
Beim autolytischen Débridement nützt man die Wirkung der körpereigenen Enzyme aus, die bei der Zersetzung von nekrotischem Gewebe mitwirken. Die Autolyse wird gefördert durch ein feuchtes Milieu unter okklusiven Bedingungen, was mit entsprechenden Wundverbänden erreicht werden kann ( siehe unten ) .
Eine häufig eingesetzte Methode ist als NassTrocken-Phase bekannt: eine nasse und anschliessend eine trockene Kompresse werden je eine Viertelstunde auf die Wunde gelegt; die trockene Kompresse soll sich mit Wundmaterial vollsaugen und so ein sanftes Débridement bewirken. Über den Nutzen sind sich die Fachleute nicht einig; von den einen als bewährte Methode geschätzt, wird sie von den anderen als nicht sehr wirkungsvoll eingestuft.
Unter den physikalischen Methoden ( Wasserstrahl, Ultraschall, Laser ) ist vor allem die Wasserstrahl-Anwendung weit verbreitet ( die im Prinzip einem chirurgischen Débridement entspricht ) . Kaum mehr angewandt wird hingegen das osmotische Débridement mit hochkonzentrierten Polysaccharid-Lösungen.
Auch die verschiedenen Débridement-Methoden sind praktisch nicht systematisch untersucht, so dass es für die Auswahl wenig handfeste Kriterien gibt. Abgesehen davon, dass das chirurgische Débridement immer als erstes Vorgehen zu prüfen ist, sollte man sich letztlich für eine Methode entscheiden, die effektiv und kostengünstig ist sowie möglichst wenig Schmerzen verursacht.
Wundauflagen und -Verbände
Es werden heute zahlreiche verschiedene Wundverbände oder
-auflagen angeboten, die im Prinzip die oben genannten Aspekte der lokalen Wundbehandlung vereinen, indem sie das Débridement unterstützen, für ein optimales Wundklima sorgen und die Wunde schützend abdecken. Allerdings gibt es keinen Wundverband, der für alle Wunden oder für alle Phasen der Wundheilung gleich geeignet ist. Die wichtigste Aufgabe eines Wundverbandes ist es, ein solches der Heilung dienliches Feuchtigkeitsmilieu zu schaffen, dass die Wunde weder ztrocken noch zu nass ist und dass das autolytische Débridemeund die Bildung von Granulationsgewebe gefördert werdeDeshalb ist die Absorptionsfähigkeit eines der Hauptkriterienach denen ein Wundverband auszuwählen ist. Ferner sollein Wundverband bakteriendicht, aber durchlässig für Sauestoff, Kohlendioxid und Wasserdampf sein, wodurch semokklusive Bedingungen geschaffen werden.
Als wichtigste Typen – viele sind in der Grösse zuschneidbarkennt man Folien, Alginate, Hydrofasern, Hydrogele, Hydrokolloide, Aktivkohle-Verbände und Schaumstoffe. DiesWundverbände erlauben es dank ihrer feuchtigkeitsregulierenden Eigenschaften, dass der Verbandwechsel nicht täglich statfinden muss, sondern dass je nach Exsudatmenge längere Zeiräume möglich sind ( unter Umständen bis zu einer WocheHäufig werden verschiedene Typen auch miteinander kombniert.(9-11)
In den Übersichtstabellen auf den Seiten 24 bis 26 sind die der Schweiz erhältlichen Wundverbände aufgeführt, die füdie Behandlung chronischer Wunden im Vordergrund steheDie Liste basiert überwiegend auf den Angaben vo«Pharmavista» ( http://www.pharmavista.ch ) . Zwangsläufkann sie keinen Anspruch auf Vollständigkeit erheben, da daAngebot an Wundverbänden immens und durch eine gewissUnübersichtlichkeit gekennzeichnet ist. Auch ist es nicht immer ganz klar, welcher Kategorie der Wundverband zuzuordnen ist. Viele Wundverbände sind in verschiedenen Grösseauf dem Markt. Die Tabellen beschränken sich jeweils aueine Grösse, wobei als «Standardgrösse» 10 mal 10 cm gwählt wurde. Falls es diese Grösse nicht gibt, wurde die disem Wert am nächsten kommende Variante ausgesucht. BeiPreis handelt es sich, wenn nicht anders vermerkt, um den Publikumspreis.
Wundverbände werden in der Schweiz in der Mittel- und Gegenstände-Liste ( MiGeL ) aufgeführt. Für solche Produkte gelten weniger strenge Richtlinien als bei Medikamenten, was Deklaration und Wirksamkeitsnachweis betreffen.
Übers Internet wird auch ein – kostenpflichtiges – Wundmaterial-Kompendium ( unter www.medinform.ch ) angeboten. Es bietet allgemeine sowie produktspezifische Informationen zu den Wundauflagen, wobei es sich auch auf Herstellerangaben stützt.
Nichthaftende Wundverbände
Bei den nichthaftenden Wundverbänden handelt es sich vor
allem um Gazen oder gröbere Gitternetze, die zum Beispiel mit Silikon beschichtet sind. Sie helfen, eine Verklebung mit dem Wundbett und Schmerzen beim Verbandwechsel zu verhindern. Bei chronischen Wunden werden sie meistens mit anderen Verbänden oder Auflagen kombiniert. Abgeraten wird von nichthaftenden Wundverbänden, die Stoffe mit allergenem Potential wie Paraffin oder Lanolin enthalten.
Wundfolien
Wundfolien sind sterile Plastikabdeckungen aus Polyurethan,
die mit einem hypoallergenen Klebstoff beschichtet sind. Sie lassen Luft und Wasserdampf, jedoch keine Flüssigkeit oder Bakterien durch. Man kann sie im Prinzip alleine anstelle eines Pflasters verwenden. Sie eignen sich nicht, wenn Exsudat vorhanden ist, weil mit einer Mazeration der darunterliegenden Haut zu rechnen wäre. So werden sie bei chronischen Wunden, als adhäsiver Sekundärverband fungierend, häufig zusammen mit anderen Wundverbänden verwendet. Selbstklebende Wundverbände sind in der Regel bereits fix mit einer Polyurethanfolie kombiniert, welche die abdichtenden Eigenschaften vermittelt.
Alginate
Alginate werden aus den Natrium- und Kalziumsalzen der
Alginsäure gewonnen, die von Braunalgen stammt. Die Alginsäure ist ein Polysaccharid, das einem Gemisch von zwei Zuckersäuren ( Guluron- und Mannuronsäure ) entspricht. Alginate können, ein hydrophiles Gel bildend, bis zum 20-'fachen ihres Eigengewichts an Flüssigkeit binden, so dass sie sich für exsudatreiche Wunden eignen. Bei Wunden mit wenig Exsudat sollten sie nicht verwendet werden, da sie dann zum Verkleben mit der Wundoberoberfläche neigen.
Hydrofasern
Hydrofasern bestehen aus Carboxymethylcellulose oder Poly-
esterfasern. Sie können ebenfalls grössere Flüssigkeitsmengen speichern ( bis zum 25-'fachen ihres Gewichts ) . Die Fasern sind so ausgerichtet, dass die Flüssigkeit primär nur vertikal aufgenommen wird, womit der Gefahr von Mazerationen am Wundrand begegnet werden soll.
Hydrogele
Hydrogele bestehen aus einer Matrix wasserunlöslicher Poly-
mere ( Gelbildner ) , die bis zu 95% Wasser enthalten. Sie können einerseits Feuchtigkeit an die Wunde abgeben, andererseits aber auch Exsudat aufnehmen. Indem sie befeuchtend wirken, fördern sie die Autolyse. Hydrogele eignen sich für eher trockene oder schmierig-belegte, nicht jedoch für stark exsudierende Wunden. Ausserhalb des Wundbetts platziert, können sie zur Mazeration des umliegenden Gewebes führen. Es gibt sie als Gel in Tuben oder Flaschen, als Gelplatten oder als Pflasterbeschichtung.
Hydrokolloide
Hydrokolloide enthalten ein hydrophobes Polymergerüst, in
das stark quellende Substanzen wie Gelatine, Pektin oder Carboxymethylzellulose eingebettet sind. Unter Flüssigkeitsaufnahme bildet sich daraus ein Gel ( dieses Gel kann einen schlechten Geruch entwickeln, was beim Entfernen des Verbandes als bakterielle Kontamination missgedeutet werden kann ) . Hydrokolloidverbände lassen selbst Luft und Wasserdampf kaum durch.
Aktivkohle-Verbände
Aktivkohle-Verbände entsprechen einem Faserverbund aus
verkohlter Zellulose. Neben der exsudataufnehmenden Eigenschaft wirken sie geruchsbindend, was bei infizierten Wunden hilfreich sein kann.
Schaumstoffe
Solche Verbände werden entweder aus einem Polyurethan-
oder einem Silikonschaum hergestellt und zeichnen sich durch sehr gute exsudatabsorbierende Eigenschaften aus.
Antimikrobielle Verbände
Einige Verbände enthalten Substanzen mit antimikrobieller
Aktivität. Am häufigsten wird Silber verwendet, das entweder fest im Verband haftet oder im feuchten Wundmilieu herausgelöst wird. Als Träger kommen verschiedene Materialien zum Einsatz wie Alginate, Hydrokolloide, Polyurethanschäume oder Polyethylengewebe. Vereinzelt sind auch Jodverbindungen oder andere antimikrobielle Substanzen zugesetzt.
Auswahl eines Wundverbandes
Zu Wundverbänden gibt es praktisch keine qualitativ hochstehenden Studien, die einen bei der Auswahl leiten. Deshalb sind auch die Aussagemöglichkeiten der systematischen Übersichten beschränkt, die hierzu veröffentlicht wurden. Eine dieser Übersichten kommt zum Schluss, dass man bei chronischen Wunden von Hydrokolloiden eine höhere Heilungsrate erwarten kann als von einfachen Gazeverbänden und dass zwischen Hydrokolloid- und Schaumstoffverbänden kein Unterschied besteht; (12)
eine andere ergab, dass bei Druckgeschwüren Hydrokolloide den herkömmlichen Verbänden überlegen sind.(13)
In einer Metaanalyse, in welcher der Effekt von Hydrokolloid-, Schaumstoff-, Hydrogel- und Alginatverbänden bei venös bedingten Beinulzera analysiert wurde, fand man dagegen keine Unterschiede, weder zwischen modernen Wundverbänden und einfachen nichthaftenden Wundauflagen noch zwischen den modernen Wundverbänden untereinander.(14)
Als Fazit bleibt, dass man sich bei der Auswahl eines Wundverbandes nicht auf eine gute Evidenz stützen kann, sondern vor allem von pathophysiologischen Überlegungen leiten lassen muss. Eine Wunde sollte gerade so feucht gehalten werden, dass sie weder austrocknet noch eine Mazeration stattfindet. Ausnahme bilden die arteriellen Nekrosen, die nicht feucht oder semiokklusiv behandelt werden dürfen. Weitere Punkte, welche die Wahl des Wundverbandes beeinflussen, sind das Wundstadium ( Reinigungs-, Granulations- oder Epithelialisierungsphase ) , das Infektrisiko und der Zustand der umgebenden Haut. Wichtig ist auch die Sicht des Patienten oder der Patientin: wenn der Wundverband hilft, Schmerzen zu reduzieren, Gerüche und herauslaufendes Exsudat zu vermindern und die Häufigkeit des Verbandwechsels zu reduzieren, kann dies einen erheblichen Komfortgewinn bedeuten. Eine Übersicht zu den Einsatzmöglichkeiten der verschiedenen hydroaktiven Wundauflagen liefert Tabelle 2. Zu beachten ist, dass bei gewissen Wundverbänden die Kassenzulässigkeit limitiert ist; so werden zum Beispiel Hydrokolloide nur während drei, in begründeten Fällen während sechs Monaten von den Kassen bezahlt.
Andere Behandlungsmethoden
Neben der «klassischen» Behandlung mit Wundverbänden
existieren noch andere Methoden, die bei chronischen Wunden unter Umständen zum Einsatz kommen können.
Hyperbarer Sauerstoff
Sauerstoff spielt bei der Wundheilung eine wichtige Rolle, und
vermutlich ist eine Hypoxie bei vielen chronischen Wunden ein grundlegender Faktor. Bei der Behandlung mit hyperbarem Sauerstoff wird die betroffene Person unter erhöhtem Umgebungsdruck intermittierend über jeweils ein bis zwei Stunden 100%igem Sauerstoff ausgesetzt. Einer weiten Verbreitung der Methode steht indessen allein schon entgegen, dass sie nur in einer Druckkammer und deshalb nur in ganz wenigen spezialisierten Zentren stattfinden kann. Kontrollierte Studien bei chronischen Wunden sind nur spärlich durchgeführt worden, so dass die Behandlung mit hyperbarem Sauerstoff eine umstrittene Massnahme ohne nennenswerte Bedeutung bleibt.
Vakuumbehandlung
Bei der Vakuumbehandlung wird ein Schaumverband mit einem kleinen Schlauch verbunden, über den ein Sog erzeugt wird. Man postuliert, dass das Vakuum die Wundheilung fördert, indem das überschüssige Exsudat entfernt, die Durchblutung und die Bildung von Granulationsgewebe verstärkt werden und der negative Druck den Wundverschluss begünstigt. Sie wird häufig für den sekundären Wundverschluss verwendet. Die Vakuumbehandlung scheint sich in ihrer Wirkung mit Wundauflagen messen zu können. Obschon dies noch kaum durch randomisierte Studien bestätigt ist,(15) wird die Vakuumbehandlung von Fachleuten als eine probate Methode angesehen, vor allem bei grossflächigen, tiefen Wunden.
Infizierte Wunden
Jede chronische Wunde ist mit Hautkeimen bakteriell kontaminiert oder kolonisiert. Solange dieses bakterielle Mikroklima im Gleichgewicht steht, kann es über die Stimulation der Granulozyten die Wundheilung sogar unterstützen. Doch das Milieu eines Ulkus – mit Feuchtigkeit, nekrotischem Gewebe und schlechter Durchblutung – ist ein guter Nährboden, auf dem sich eine manifeste Infektion entwickeln kann, welche die Wundheilung hemmt. Die Diagnose eines Wundinfekts wird primär klinisch gestellt, kann aber zuweilen schwierig sein: einerseits können die typischen Entzündungszeichen fehlen, andererseits können sie auch vorhanden sein, ohne dass ein bakterieller Infekt vorliegt ( z.B. bei einer Stauungsdermatitis ) . Ein dringender Verdacht auf einen beginnenden Infekt ( wofür zum Teil auch der Begriff «kritische Kolonisation» verwendet wird ) lässt sich ableiten, wenn vermehrte Exsudation, Schmerzen, übler Geruch, sprödes Granulationsgewebe oder eine Heilungsverzögerung bestehen. Kulturen können ergänzende Informationen vermitteln, wobei die Entnahme von Gewebeproben anzustreben ist; Wundabstriche werden nicht empfohlen, da sie zuwenig sensitiv und spezifisch sind. Die meisten Wunden enthalten verschiedenartige Keime; am häufigsten nachgewiesen wird Staphylococcus aureus.
Infizierte Wunden sollen wie andere Wunden gereinigt und débridiert werden, dürfen aber nicht mit semiokklusiven Verbänden abgedeckt werden. Wenn der Infekt auf die Wunde beschränkt ist, kann eine Lokalbehandlung mit Antiseptika durchgeführt werden. Etliche dieser Substanzen sind aber bei chronischen Wunden obsolet oder kaum mehr gebräuchlich, vor allem weil sie vermutlich gewebetoxisch wirken; dazu gehören oxidierende Substanzen ( Wasserstoffperoxid u.a. ) oder zum Beispiel Chlorhexidin. Laut Expertenmeinung ist Polihexanid ( Lavasept®, Prontosan®) das geeignetste Antiseptikum; als Alternativen werden Octenidin ( Octenisept®) oder Jodophore ( z.B. Povidon-Jod [Betadine® u.a.] ) angeführt.(16)
Sehr verbreitet sind auch silberhaltige Präparate. Ob Silber infizierte Wunden rascher abheilen lässt, ist freilich nicht überzeugend nachgewiesen.(17)
Als entbehrliche Silberverbindung wird Silbersulfadiazin bezeichnet, dessen Nachteile darin liegen, dass
16es zytotoxisch und allergen wirken kann und die Salbe – falls in dieser Form verabreicht – auf der Wundoberfläche mit Eiweissen schwerlösliche Komplexe bildet.(16) Ebenso ist von lokal angewandten Antibiotika abzuraten, deren mögliche Probleme einen Nutzen überwiegen. Theoretisch kämen für die lokale Infektbehandlung auch Verbände mit Honig in Frage, wobei es aber keine Evidenz gibt, dass er die Abheilung chronischer Wunden verbessert.(18)
Eine systemische Antibiotika-Behandlung ist dann indiziert, falls klinisch oder serologisch ( Anstieg des CRP-Spiegels ) eine Ausbreitung des Infekts zu vermuten ist. Die Wahl und der Verabreichungsweg ( oral, parenteral ) eines Antibiotikums sowie die Therapiedauer hängen von der klinischen Situation ab. Häufig eingesetzte Antibiotika sind Betalaktame, Chinolone oder Clindamycin ( Dalacin® C u.a. ).(19)
Schlussfolgerungen
Jede Therapie einer chronischen Wunde sollte damit beginnen,
dass man die Ursache klärt und entsprechend behandelt. Danach muss versucht werden, mit einer geeigneten Lokalbehandlung die Abheilung der Wunde zu unterstützen. Dabei hat sich heute für die meisten Wundursachen das Konzept der feuchten Behandlung durchgesetzt. Die Verwendung von feuchten Kompressen, die man täglich ( eventuell sogar mehrmals ) wechselt, ist grossenteils verlassen. Stattdessen setzt man Wundverbände ein, deren Auswahl man dem Zustand der Wunde anpassen kann. Medizinisch gesehen darf man den Wert dieser Wundverbände jedoch nicht überschätzen. So ist nicht schlagend bewiesen, dass sie Wunden besser zur Abheilung verhelfen als althergebrachte Feuchtkompressen oder nicht-haftende Wundverbände. Viel entscheidender als die Wahl des Verbandes dürfte die fachgerechte Wundpflege sein, was im Prinzip auch mit einfachen Mitteln gewährleistet werden kann. Der Hauptvorteil der modernen Wundverbände liegt im Komfort, den sie dem Pflegepersonal und den Betroffenen bieten – dass sie einfach zu applizieren sind, nicht täglich gewechselt werden müssen und weniger Einschränkungen im Alltagsleben erfordern. Der Preisunterschied zwischen Wundverbänden und einer simplen Feuchtkompresse ist im Allgemeinen beträchtlich. Dass dieser Unterschied aufgehoben würde, weil die Wundverbände einen geringeren pflegerischen Aufwand erforderten, ist ein häufig geäussertes Argument, das sich aber nicht immer mit den Alltagserfahrungen der Fachleute deckt.
Angesichts des unübersichtlichen Angebots und der ausufernden Vielfalt im Bereich der Wundverbände ist es eine grosse Herausforderung, bewährten medizinischen Prinzipien zu folgen und medizinische Evidenz nicht mit industrievermittelten Moden zu mischen – was inbesondere auch für die mittlerweile zahlreichen Pflegefachleute gilt, die eine Zusatzausbildung als Wundexpertinnen und -experten absolviert haben. Schon allein aus ökonomischer Verantwortung ist darauf zu achten, dass man rationalen Kriterien folgt und teure Wundverbände nicht unbedacht verwendet.
Literatur
- 1) Schwegler B. pharma-kritik 2003; 25: 41-4
- 2) Grey JE et al. BMJ 2006; 332: 472-5
- 3) McInnes E et al. Cochrane Database Syst Rev 2008; ( 4 ) : CD001735
- 4) Reddy M et al. JAMA 2006; 296: 974-8
- 5) Moore Z, Cowman S. J Clin Nurs 2008; 17: 1963-72
- 6) O’Meara S et al. Cochrane Database Syst Rev 2010; ( 1 ) : CD003557
- 7) Bradley M et al. Health Technol Assess 1999; 3: iii-iv, 1-78
- 8) Chan DC et al. Hong Kong Med J 2007; 13: 382-6
- 9) Dissemond J. Hautarzt 2006; 57: 881-7
- 10) Jones V et al. BMJ 2006; 332: 777-80
- 11) Donaty E. In: Wild T, Auböck J, eds. Manual der Wundheilung. Wien: Springer; 2007, p.23-9
- 12) Chaby G et al. Arch Dermatol 2007; 143: 1297-304
- 13) Heyneman A et al. J Clin Nurs 2008; 17: 1164-73
- 14) Palfreyman S et al. BMJ 2007; 335: 244
- 15) Ubbink DT et al. Cochrane Database Syst Rev 2008; ( 3 ) : CD001898
- 16) Kramer A et al. Z Wundheil 2004; 9: 110-20
- 17) Vermeulen H et al. Cochrane Database Syst Rev 2007; ( 1 ) : CD005486
- 18) Jull AB et al. Cochrane Database Syst Rev 2008; ( 4 ) : CD005083
- 19) Hernandez R. Dermatol Ther 2006; 19: 326-37
- 20) http://www.safw.ch/_ablage/behandlung.htm
Standpunkte und Meinungen
- Es gibt zu diesem Artikel keine Leserkommentare.
Copyright © 2024 Infomed-Verlags-AG
PK771
Verwandte Artikel
Gratisbuch bei einem Neuabo!
pharma-kritik abonnieren
-
Jahrgang 45 / 2023
Jahrgang 44 / 2022
Jahrgang 43 / 2021
Jahrgang 42 / 2020
Jahrgang 41 / 2019
Jahrgang 40 / 2018
Jahrgang 39 / 2017
Jahrgang 38 / 2016
Jahrgang 37 / 2015
Jahrgang 36 / 2014
Jahrgang 35 / 2013
Jahrgang 34 / 2012
Jahrgang 33 / 2011
Jahrgang 32 / 2010
Jahrgang 31 / 2009
Jahrgang 30 / 2008
Jahrgang 29 / 2007
Jahrgang 28 / 2006
Jahrgang 27 / 2005
Jahrgang 26 / 2004
Jahrgang 25 / 2003
Jahrgang 24 / 2002
Jahrgang 23 / 2001
Jahrgang 22 / 2000
Jahrgang 21 / 1999
Jahrgang 20 / 1998
Jahrgang 19 / 1997
Jahrgang 18 / 1996
Jahrgang 17 / 1995
Jahrgang 16 / 1994
Jahrgang 15 / 1993
Jahrgang 14 / 1992
Jahrgang 13 / 1991
Jahrgang 12 / 1990
Jahrgang 11 / 1989
Jahrgang 10 / 1988
Kennen Sie "100 wichtige Medikamente" schon?
Die Liste der 100 Medikamente sehen Sie auf der Startseite von 100 Medikamente.


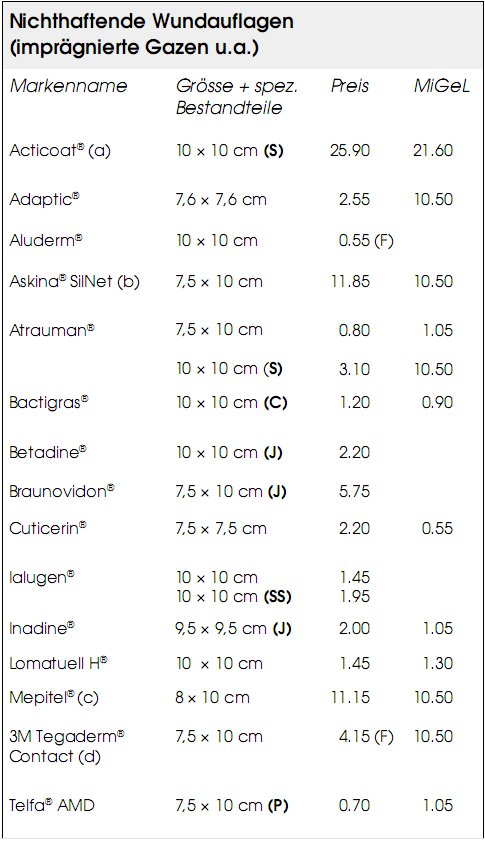




 Legende zu den Tabellen auf den Seiten 24-26:
Preis: Preis für die angegebene Grösse ( CHF )
MiGeL: Höchstvergütungsbetrag ( CHF ) gemäss Mittel- und Gegenstände-Liste ( MiGeL) , sofern publiziert
( a ) Kunstseide/Polyesterkern + Polyethylengitter ( b ) Silikonbeschichtet ( c ) Silikongitter ( d ) Nylon-Wundauflage ( e ) Kombination mit Schaumstoff ( f) Gel, Kombination mit Alginat
( C ) enthält Chlorhexidin ( F ) Fabrikabgabepreis
( H ) enthält Honig ( J ) enthält Jod ( P ) enthält Polyhexamid ( S ) enthält Silber ( SS ) enthält Silber-Sulfadiazin
Legende zu den Tabellen auf den Seiten 24-26:
Preis: Preis für die angegebene Grösse ( CHF )
MiGeL: Höchstvergütungsbetrag ( CHF ) gemäss Mittel- und Gegenstände-Liste ( MiGeL) , sofern publiziert
( a ) Kunstseide/Polyesterkern + Polyethylengitter ( b ) Silikonbeschichtet ( c ) Silikongitter ( d ) Nylon-Wundauflage ( e ) Kombination mit Schaumstoff ( f) Gel, Kombination mit Alginat
( C ) enthält Chlorhexidin ( F ) Fabrikabgabepreis
( H ) enthält Honig ( J ) enthält Jod ( P ) enthält Polyhexamid ( S ) enthält Silber ( SS ) enthält Silber-Sulfadiazin 

