Behandlung des Mammakarzinoms
- Autor(en): Urspeter Masche
- Reviewer: Nicole Bürki, Monica Castiglione, Urban Laffer, Urs Strebel, Beat Thürlimann
- pharma-kritik-Jahrgang 25
, Nummer 12, PK84
Redaktionsschluss: 5. November 2003
DOI: https://doi.org/10.37667/pk.2003.84 - PDF-Download der Printversion dieser pharma-kritik Nummer
Update
Das Mammakarzinom ist bei uns mit einem Anteil von 30% der häufigste bösartige Tumor der Frau. Die Ätiologie ist nicht bekannt, doch existieren etliche Risikofaktoren. Die beiden wichtigsten sind gewisse In-situ-Karzinome sowie Brustkrebs in der nahen Verwandschaft. Etwa 5% der Mammakarzinome folgen einem Vererbungsmuster, wobei sich meistens Mutationen in Tumorsuppressor-Genen (BRCA-1 und BRCA-2) nachweisen lassen. Weitere Beispiele für Risikofaktoren sind frühe Menarche, späte Menopause, Kinderlosigkeit, Hormonsubstitution in der Menopause und übermässiger Alkoholkonsum.
Es gibt einerseits die In-situ-Karzinome, andererseits die invasiven Tumoren, die nach dem TNM-System in vier Stadien unterteilt werden. Unter den diagnostizierten Brustkrebs-Fällen haben die Frühstadien in den letzten Jahren zugenommen, was als Folge der vermehrt durchgeführten Mammographien interpretiert werden kann.
Der Hauptprognosefaktor ist das Tumorstadium; insbesondere spielt es eine Rolle, ob und wieviele regionäre Lymphknoten befallen sind. Andere Eigenschaften des Tumors – Hormonrezeptoren, Differenzierungsgrad, proliferative Aktivität (S-Phasen- Anteil), Ausmass der Gefässinvasion und der Expression von Wachstumsfaktoren (z.B. HER-2) – beeinflussen die Prognose ebenfalls.
In-situ-Karzinome
Das lobuläre Carcinoma in situ kann lediglich histologisch nachgewiesen werden und ist typischerweise eine Zufallsdiagnose aus einer Biopsie. Es stellt keine eigentliche Karzinomvorstufe dar, sondern nur einen – beide Brüste betreffenden – Risikofaktor. In der Regel führt man eine lokale Exzision durch, gefolgt von regelmässigen Kontrollen. Eine prophylaktische Behandlung mit Tamoxifen (Nolvadex® u.a.) über fünf Jahre kann das Risiko eines invasiven Karzinoms mehr als halbieren.(1)
Aus einem duktalen Carcinoma in situ kann sich hingegen direkt ein invasives Karzinom entwickeln. Meistens führt ein abnormer Mammographie-Befund, zuweilen auch ein palpabler Knoten zur Diagnose. Die Therapie besteht aus einer lokalen Exzision, häufig verbunden mit einer Radiotherapie, oder aus einer Mastektomie. Ebenfalls kann eine Prophylaxe mit Tamoxifen diskutiert werden.(2)
Karzinome im Frühstadium
Hierzu gehören die Stadien I, II und IIIA, in denen der Primärtumor auf die Brust beschränkt ist. Das Konzept der Behandlung ist eine Operation, in den meisten Fällen gefolgt von einer medikamentösen Behandlung und Bestrahlung.
Chirurgische Behandlung
Bei der chirurgischen Behandlung stehen eine brusterhaltende Operation oder eine modifiziert radikale Mastektomie zur Wahl. Beide Methoden sind bezüglich Überlebenswahrscheinlichkeit als gleichwertig zu betrachten, abgesehen von wenigen Ausnahmen, in denen man zur Mastektomie raten wird.(3) In der Regel werden auch die axillären Lymphknoten reseziert. Neben dem Staging dient dies der lokalen Tumorkontrolle, indem einem späteren Lymphknotenbefall vorgebeugt oder bereits befallene Lymphknoten entfernt werden.(4)Nach einer Axillaausräumung warten allerdings Probleme wie Wundinfekte, Schmerzen, Lymphödem oder Bewegungseinschränkung in Schulter und Arm. Deshalb wurde als schonendere Methode das Konzept des «Sentinel»-Lymphknotens bzw. «Wächter- Lymphknotens» entwickelt: es wird ein Farbstoff oder Radioisotop in das tumorumliegende Brustgewebe gespritzt; die ersten Lymphknoten, die der Marker erreicht, werden dann histologisch untersucht; nur wenn diese Lymphknoten befallen sind, wird eine Axillaausräumung angeschlossen. Wenngleich die Bestätigung durch Langzeit-Daten noch fehlt, sind die ersten Resultate vielversprechend.(5)
Adjuvante Radiotherapie
Gemäss einer Metaanalyse senkt eine Nachbestrahlung sowohl nach brusterhaltender Operation wie nach Mastektomie die Lokalrezidiv-Rate von 30 auf 10%, wobei die relative Risikoreduktion unabhängig ist vom Lymphknotenstatus und einer zusätzlichen adjuvanten medikamentösen Behandlung. Das Risiko, an Brustkrebs zu sterben, wird durch die Radiotherapie von 51 auf 47% vermindert. Die Gesamtmortalität reduziert sich jedoch nicht, da andere Todesursachen zunehmen; vor allem sind vaskulär bedingte Todesfälle deutlich häufiger, möglicherweise weil durch die Bestrahlung Herz und grosse Gefässe in Mitleidenschaft gezogen werden. Diese Daten stammen allerdings aus älteren Studien, in denen gegenüber heutigen Methoden weniger schonende Bestrahlungstechniken angewandt wurden.
Von einer Nachbestrahlung profitieren in erster Linie junge Frauen und solche mit einem hohen Lokalrezidiv-Risiko. Wenn eine Patientin älter als 60 Jahre alt ist oder wenn das Lokalrezidiv-Risiko als gering einzustufen ist – zum Beispiel bei nodal negativen Tumoren nach Mastektomie und Axillaausräumung –, beginnen die Nachteile zu überwiegen.(6) In einem Editorial wird darauf hingewiesen, dass mit den modernen Bestrahlungstechniken die intrathorakalen Organe besser geschont werden; es sei deshalb davon auszugehen, dass sich die Radiotherapie auch auf die Gesamtmortalität positiv auswirke.(7)
Adjuvante endokrine Therapie
Mit Tamoxifen kann bei Tumoren mit positiven Östrogenrezeptoren die Häufigkeit von Tumorrezidiven von 38 auf 23% und die Gesamtmortalität von 28 auf 22% gesenkt werden. Bei negativen Östrogenrezeptoren besteht kaum ein Effekt. Dagegen ist die schützende Wirkung unabhängig von einem axillären Lymphknotenbefall, einer zusätzlichen adjuvanten Chemotherapie oder dem Menopausenstatus.(8) Die bestmögliche Wirkung erreicht man, wenn Tamoxifen fünf Jahre lang eingenommen wird; eine über fünfjährige Behandlung ist von unklarem Nutzen und ausserhalb klinischer Studien nicht empfohlen. Wenn Tamoxifen und eine Chemotherapie vorgesehen sind, soll Tamoxifen erst nach Abschluss der zytostatischen Behandlung eingesetzt werden (sequentielle Therapie).(9) Die häufigsten Nebenwirkungen von Tamoxifen sind Hitzewallungen, Übelkeit und vaginaler Ausfluss. Auch das Risiko einer Thromboembolie, eines Endometriumkarzinoms und – bei jungen Frauen – einer Osteoporose nimmt zu. Bei funktionierendem Ovar erhöht Tamoxifen reaktiv den Östradiol-Spiegel, was möglicherweise einen Teil der Tamoxifen-Wirkung aufhebt und für eine zusätzliche Ovarektomie sprechen würde (bei fortgeschrittenem Mammakarzinom ist nachgewiesen, dass die Kombination von Tamoxifen mit einem Gonadotropin-Agonisten günstiger ist als die entsprechenden Monotherapien).(10)
Mit einer Ovarektomie in der Prämenopause – heute vor allem medikamentös mit Gonadotropin-Agonisten durchgeführt – lässt sich die rückfallfreie Zeit und die gesamte Überlebensrate absolut um rund 6% senken, wie in einer Metaanalyse zusammengestellt ist. Der Vorteil beschränkt sich auf Tumoren mit positiven Östrogenrezeptoren.(11) In gewissen Fällen können Gonadotropin-Agonisten, mit oder ohne Tamoxifen, sogar eine Alternative zur Chemotherapie sein.(12,13)
Aromatasehemmer blockieren bei Frauen nach der Menopause die Umwandlung von Androgenen zu Östrogenen, die in peripheren Geweben stattfindet. Aminoglutethimid (Orimeten®), der erste Vertreter aus dieser Gruppe, ist unterdessen durch selektivere Substanzen abgelöst worden: Exemestan (Aromasin®) ist ein Derivat von Androstendion; Anastrozol (Arimidex®) und Letrozol (Femara®) sind Substanzen ohne Steroidstruktur. Aromatasehemmer wurden ursprünglich beim metastasierenden Mammakarzinom eingesetzt, kommen indessen auch als primäre endokrine Therapie in Frage, wie neue Daten zeigen. In einer Studie mit über 9000 Patientinnen in der Postmenopause wurde entweder Anastrozol, Tamoxifen oder beide Mittel zusammen verordnet. Nach einer medianen Beobachtungszeit von knapp drei Jahren war in der Anastrozol- Gruppe bei 7,6% der Frauen ein Rückfall oder ein kontralaterales Mammkarzinom aufgetreten; bei Tamoxifen betrug dieser Prozentsatz 9,6%, bei der Kombination 10,0%. In den Überlebensraten war kein Unterschied festzustellen. Die überlegene Wirkung von Anastrozol war nur bei Tumoren mit positiven Hormonrezeptoren nachweisbar. Unter Anastrozol traten weniger Hitzewallungen, thromboembolische Ereignisse und Endometriumkarzinome auf als unter Tamoxifen, jedoch mehr Muskel- und Skelettbeschwerden sowie Knochenfrakturen.(14) Da sich aber die volle Wirkung von Tamoxifen erst nach einerfünfjährigen Therapie abschätzen lässt, braucht es Langzeitdaten, um einen Vorteil der rund siebenmal teureren Aromatasehemmer zu belegen. Vorerst sollen sie nur verwendet werden, wenn Tamoxifen kontraindiziert ist oder nicht vertragen wird. Wenn Aromatasehemmer im Anschluss an eine fünfjährige Tamoxifen-Behandlung eingesetzt werden, erreicht man möglicherweise eine zusätzliche rückfallverhütende Wirkung, worauf eine soeben veröffentlichte Untersuchung hindeutet, die mit Letrozol durchgeführt wurde.(15)
Adjuvante Chemotherapie
Die adjuvante Chemotherapie begann sich vor etwa dreissig Jahren zu etablieren – zunächst als Monotherapie, später in Form der wirksameren Kombinationstherapie. Durch eine Chemotherapie wird sowohl das Risiko eines Rückfalls und eines kontralateralen Mammakarzinoms als auch die Mortalität signifikant herabgesetzt – unabhängig vom Hormonrezeptorstatus und einer gleichzeitigen Tamoxifen-Behandlung. Gemäss einer Metaanalyse verbessert die Chemotherapie bei Frauen unter 50 Jahren die Zehnjahresüberlebensrate von 71 auf 78% (ohne Lymphknotenbefall) und von 42 auf 53% (mit Lymphknotenbefall);
bei Frauen zwischen 50 und 70 Jahren erhöht sie sich von 67 auf 69% bzw. von 46 auf 49%. Die Wirkung nimmt also mit zunehmendem Alter ab und verliert sich bei über 70-Jährigen (wobei dieses Kollektiv mit rund 600 Frauen klein war). Chemotherapie-Schemen, welche die Anthrazykline Doxorubicin (Adriblastin® u.a.) oder Epirubicin (Farmorubicin®) enthalten, bieten einen Vorteil gegenüber dem lange als Standard geltenden CMF-Schema mit Cyclophosphamid (Endoxan ®), Methotrexat und 5-Fluorouracil: nach fünf Jahren ist der Anteil der Frauen, die keinen Rückfall erlitten haben bzw. noch leben, mit einem anthrazyklinhaltigen Schema 57 bzw. 72%, mit dem CMF-Schema 54 bzw. 69%.(16) Taxane, Docetaxel (Taxotere®) und Paclitaxel (Taxol®), führen ebenfalls zu einer hohen Ansprechrate. Die vorhandenen Daten liefern aber noch zuwenig Klarheit, ob Taxane die Wirksamkeit der anthrazyklinhaltigen adjuvanten Chemotherapie verbessern können, so dass man weitere Studienresultate abwarten muss.(17)
Bei einer Chemotherapie ist immer mit erheblichen Nebenwirkungen zu rechnen. Typisch sind gastrointestinale Probleme (Übelkeit, Erbrechen, Durchfall und Stomatitis), Knochenmarkssuppression, Haarausfall und Müdigkeit; auch das Thromboembolie-Risiko ist – unabhängig von einer Tamoxifen- Behandlung – vermutlich erhöht. Nach einer Chemotherapie können sich verschiedene Langzeiteffekte manifestieren. Etliche Frauen sind von einer Gewichtszunahme von mehreren Kilogramm betroffen. Bei den Anthrazyklinen ist die Kardiotoxizität zu beachten. In der Prämenopause wird oft die Ovarfunktion beeinträchtigt, was mit Infertilität oder einer vorzeitigen Menopause einhergehen kann. Eventuell erhöht eine Chemotherapie geringfügig das Risiko eines myelodysplastischen Syndroms oder einer Leukämie. Auch Auswirkungen auf die kognitiven Funktionen werden diskutiert.(18)
Umso wichtiger ist es, Untergruppen von Tumoren zu definieren, bei denen eine Chemotherapie keinen Vorteil verspricht. Wichtiges Beispiel sind Hormonrezeptor-positive und somit einer endokrinen Therapie zuführbare Tumoren, die höchstens 2 cm gross sind, keinen axillären Lymphknotenbefall zeigen und weitere günstige Prognosefaktoren aufweisen; ferner dürfte eine generelle Zurückhaltung bei Patientinnen über 70 Jahren angebracht sein.(19)
Lokal fortgeschrittene Karzinome
Zu den lokal fortgeschrittenen Karzinomen gehören Mammakarzinome, bei denen die Organgrenzen der Brust durchbrochen sind oder die Metastasierung in die regionären Lymphknoten weit fortgeschritten ist (Stadium IIIB/C). Ferner wird das inflammatorische Mammakarzinom dazu gezählt. Meist ist der Tumor so weit fortgeschritten, dass sich eine Operation als erste Behandlung ausschliesst; Hinweise sind zum Beispiel ein Befall der supraklavikulären Lymphknoten, Ulzerationen oder ein ausgedehntes Hautödem der Brust oder des Armes. Man verordnet in diesen Fällen primär eine Chemotherapie, weil die Wahrscheinlichkeit von Mikrometastasen sehr hoch und eine Resektion mit tumorfreien Schnitträndern kaum möglich ist. Das weitere Prozdere besteht in Regel aus einer Operation und einer Bestrahlung. Zudem wird bei Hormonrezeptor-positiven Tumoren eine endokrine Behandlung empfohlen.
Metastasierendes Karzinom
Sobald sich beim Mammakarzinom Fernmetastasen entwickelt haben (was dem Stadium IV entspricht), gibt es meistens keine kurative Therapie mehr; Hauptziel ist, die Überlebenszeit bei bestmöglicher Lebensqualität zu verlängern. In den meisten Fällen handelt es sich um Frauen, bei denen ein Mammakarzinom bekannt und bereits einmal behandelt worden ist.
Zur systemischen Behandlung stehen in erster Linie endokrine und zytostatische Therapien zur Verfügung. Welche Möglichkeit gewählt wird, hängt von verschiedenen Faktoren ab. Sehr wichtig ist der Status der Hormonrezeptoren: bei positiven Östrogen- und Progesteronrezeptoren erreicht man mit einer endokrinen Therapie eine Ansprechrate von über 60%, während sie unter 10% liegt, wenn die Hormonrezeptoren negativ sind. Eine endokrine Therapie ist auch zu favorisieren, wenn
eine Patientin früher bereits darauf angesprochen hat. Frauen mit einer ausgedehnten viszeralen Metastasierung profitieren dagegen eher von einer sofortigen Chemotherapie.(20)
Für eine endokrine Therapie ist Tamoxifen das am besten dokumentierte Medikament. In der Prämenopause ist die Kombination mit einer Ovarektomie zu erwägen. In der Postmenopause sind die Aromatasehemmer die wichtigste Alternative zu Tamoxifen; in einer Studie war Letrozol hinsichtlich Ansprechrate und progressionsfreiem Intervall sogar signifikant wirksamer als Tamoxifen, was auch bei der medianen Gesamtüberlebenszeit zu einem kleinen Gewinn führte (34 gegenüber 30 Monaten).(21) Anastrozol zeigte sich in einem Vergleich mit Tamoxifen ebenfalls als leicht überlegen.(22) Als weitere Substanzen kommen zum Beispiel Gestagene wie Megestrol (Megestat®) in Frage.
Bei der Chemotherapie des metastasierenden Mammakarzinoms gilt eine Behandlung mit einem Anthrazyklin, bzw. dem Anthrazyklin-Derivat Mitoxantron (Novantron®) oder mit einem Taxan am wirksamsten.(23) Jedoch wird man, falls bereits eine (adjuvante) Chemotherapie stattgefunden hat, nicht mehr dieselben Zytostatika verwenden – ausser wenn das krankheitsfreie Intervall über ein Jahr gedauert hat. Wenn Anthrazykline oder Taxane nicht einsetzbar sind, werden zum Beispiel Cyclophosphamid, Chlorambucil (Leukeran®), 5-Fluorouracil, Methotrexat, Vinorelbin (Navelbine®) oder Capecitabin (Xeloda®) empfohlen. Capecitabin ist ein «Prodrug», das über mehrere Schritte abgebaut und erst in den Tumorzellen zum aktiven 5-Fluorouracil umgewandelt wird.
Eine Hochdosis-Chemotherapie verbessert nach heutiger Kenntnis die Prognose nicht: in einem Vergleich zwischen einer konventionellen Chemotherapie und einer Hochdosis- Chemotherapie mit Stammzell-Transplantation fand man bei der Überlebenszeit keinen signifikanten Unterschied.(24)
Bei rund einem Viertel der Mammakarzinome findet sich eine verstärkte Expression des Wachstumsfaktors HER-2. In diesen Fällen kann eine Behandlung mit Trastuzumab (Herceptin®) versucht werden, einem monoklonalen Antikörper, der sich an den HER-2-Rezeptor bindet. In einer grossen Studie bei Patientinnen mit einem metastasierenden Mammakarzinom konnte durch die Zugabe von Trastuzumab zur Chemotherapie die Ansprechrate im Vergleich zur Kontrollgruppe signifikant verbessert werden, was sich in einer Verlängerung der medianen Überlebenszeit von 20 auf 25 Monate widerspiegelte.(25) Zur Monotherapie mit Trastuzumab gibt es keine kontrollierten Studien. Trastuzumab kann die Herzfunktion beeinträchtigen und Symptome einer Herzinsuffizienz hervorrufen; deshalb ist besonders in Kombination mit Anthrazyklinen Vorsicht geboten. Ferner können unter Trastuzumab Überempfindlichkeitsreaktionen auftreten.
Neben der Hormon- und Chemotherapie spielen beim metastasierenden Mammakarzinom auch andere Massnahmen eine wichtige Rolle. Besonders eine radioonkologische, aber auch eine chirurgische Behandlung können zur Behandlung von Metastasen oder anderen lokalen Problemen hilfreich sein. Bei manifesten Knochenmetastasen wirken Bisphosphonate wie z.B. Pamidronat (Aredia®), in Kombination mit einer Hormon- oder Chemotherapie, günstig. Sie lindern unter anderem die Schmerzen und senken das Risiko von «Skelett-Komplikationen» (Fraktur, Erfordernis einer Radiotherapie, Rückenmarkskompression u.a.).(26)
Schlussfolgerungen
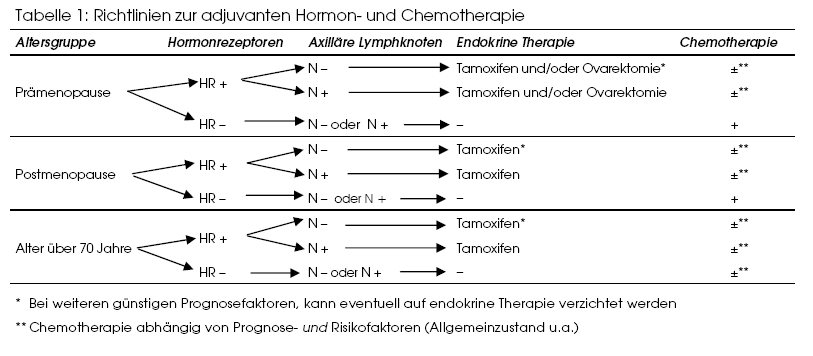
Vor bald 15 Jahren ist in pharma-kritik die letzte Übersicht zum Mammakarzinom erschienen.(27) Bei der chirurgischen Behandlung hat sich die brusterhaltende Operation unterdessen etabliert. Die Entwicklung der «Sentinel»-Methode zur Lymphknotenexploration ist ein weiterer Schritt, den Primäreingriff möglichst schonend durchzuführen. Es sind auch mehrere Metaanalysen erschienen, die den Wert der verschiedenen adjuvanten Behandlungen definieren (eine ergänzende Zusammenfassung zur adjuvanten Medikamentenbehandlung bietet das vereinfachte Schema in Tabelle 1). Eine fünfjährige Behandlung mit Tamoxifen kann als Standard gelten bei fast allen Hormonrezeptor-positiven Tumoren, wobei in der Prämenopause Gonadotropin-Agonisten eine sinnvolle Ergänzung bedeuten können. Bei der endokrinen Therapie werden in Zukunft wahrscheinlich auch die Aromatasehemmer eine wichtige Rolle spielen. Für die Chemotherapie beim Mammakarzinom sind Anthrazykline die wirksamsten Substanzen. Taxane dienen beim metastasierenden Mammakarzinom als wichtigste Reservemittel, wenn Anthrazykline nicht (mehr) in Frage kommen.
Wer vertiefte Informationen sucht, findet mit der diesjährigen Nummer 38 der Schweizerischen Ärztezeitung ein ganzes Heft, das dem Mammakarzinom gewidmet ist,(28) das unterstreicht, wie essentiell die enge interdisziplinäre Zusammenarbeit bereits zu Beginn der Behandlung ist. Auch die St. Galler Konsensus-Konferenz, die regelmässig stattfindet, hat vor einem halben Jahr aktuelle Richtlinien herausgegeben.(9)
Literatur
- 1) Fisher B et al. J Natl Cancer Inst 1998; 90: 1371-88
- 2) Fisher B et al. Lancet 1999; 353: 1993-2000
- 3) http://www.cmaj.ca/cgi/content/full/167/2/154/DC1/1
- 4) http://www.cmaj.ca/cgi/data/158/3/DC1/5
- 5) Cantin J et al. Can Med Assoc J 2001; 165: 166-73
- 6) Early Breast Cancer Trialists' Collaborative Group. Lancet 2000; 355: 1757-70
- 7) Kurtz JM. Lancet 2000; 355: 1739-40
- 8) Early Breast Cancer Trialists' Collaborative Group. Lancet 1998; 351: 1451-67
- 9) Goldhirsch A et al. J Clin Oncol 2003; 21: 3357-65
- 10) Klijn JG al. J Natl Cancer Inst 2000; 92: 903-11
- 11) Early Breast Cancer Trialists' Collaborative Group. Lancet 1996; 348: 1189-96
- 12) Jakesz R et al. J Clin Oncol 2002; 20: 4621-7
- 13) Jonat W et al. J Clin Oncol 2002; 20: 4628-35
- 14) The ATAC (Arimidex, Tamoxifen Alone or in Combination) Trialists' Group. Lancet 2002; 359: 2131-9
- 15) Goss PE et al. N Engl J Med 2003; 349: 1793-803
- 16) Early Breast Cancer Trialists' Collaborative Group. Lancet 1998; 352: 930-42
- 17) Piccart MJ et al. J Natl Cancer Inst Monogr 2001; 30: 88-95
- 18) Partridge AH et al. J Natl Cancer Inst Monogr 2001; 30: 135-42
- 19) Morrow M, Krontiras H. J Natl Cancer Inst Monogr 2001; 30: 109-13
- 20) Oratz R et al. In: Roses DF, ed. Breast Cancer. New York: Churchill Li vingstone, 1999: 511-76
- 21) Mouridsen H et al. J Clin Oncol 2003; 21: 2101-9
- 22) Bonneterre J et al. Cancer 2001; 92: 2247-58
- 23) Ghersi D et al. Cochrane Database Syst Rev 2003; (3): CD003366
- 24) Stadtmauer EA et al. N Engl J Med 2000; 342: 1069-76
- 25) Slamon DJ et al. N Engl J Med 2001; 344: 783-92
- 26) Pavlakis N, Stockler M. Cochrane Database Syst Rev 2002; (1): CD003474
- 27) Joss R, Brand B. pharma-kritik 1989; 11: 13-6
- 28) http://www.saez.ch/html/2003/2003-38.html
Standpunkte und Meinungen
- Es gibt zu diesem Artikel keine Leserkommentare.
Copyright © 2024 Infomed-Verlags-AG
PK84
Verwandte Artikel
Gratisbuch bei einem Neuabo!
pharma-kritik abonnieren
-
Jahrgang 45 / 2023
Jahrgang 44 / 2022
Jahrgang 43 / 2021
Jahrgang 42 / 2020
Jahrgang 41 / 2019
Jahrgang 40 / 2018
Jahrgang 39 / 2017
Jahrgang 38 / 2016
Jahrgang 37 / 2015
Jahrgang 36 / 2014
Jahrgang 35 / 2013
Jahrgang 34 / 2012
Jahrgang 33 / 2011
Jahrgang 32 / 2010
Jahrgang 31 / 2009
Jahrgang 30 / 2008
Jahrgang 29 / 2007
Jahrgang 28 / 2006
Jahrgang 27 / 2005
Jahrgang 26 / 2004
Jahrgang 25 / 2003
Jahrgang 24 / 2002
Jahrgang 23 / 2001
Jahrgang 22 / 2000
Jahrgang 21 / 1999
Jahrgang 20 / 1998
Jahrgang 19 / 1997
Jahrgang 18 / 1996
Jahrgang 17 / 1995
Jahrgang 16 / 1994
Jahrgang 15 / 1993
Jahrgang 14 / 1992
Jahrgang 13 / 1991
Jahrgang 12 / 1990
Jahrgang 11 / 1989
Jahrgang 10 / 1988
Kennen Sie "100 wichtige Medikamente" schon?
Die Liste der 100 Medikamente sehen Sie auf der Startseite von 100 Medikamente.